题目内容
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O22SO3,其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )
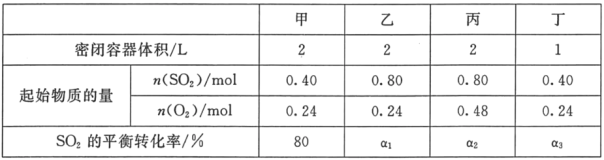
A.该温度下,该反应的平衡常数K为400
B.SO2的平衡转化率:a1>a2=a3
C.达到平衡时,容器丁中的正反应速率比容器丙中的大
D.达到平衡时,容器丙中c( SO3)大于容器甲中c( SO3)的两倍
【答案】AD
【解析】
对比四个容器投料和体积,乙与甲比较, SO2的投料加倍了,则平衡正向移动;丙与甲比较,投料是甲的两倍,相当于增大了压强,平衡正向移动;丁与甲比较,体积缩小了一倍,也相当于增大了压强,平衡正向移动。
A、2SO2+O22SO3,
开始 0.2 0.12 0
转化 0.16 0.08 0.16
平衡 0.04 0.04 0.16
K=![]() =400,故A正确;
=400,故A正确;
B、乙、丙相比,丙中氧气浓度大,丙、丁相比浓度相同,则SO2的平衡转化率:a1<a2=a3,故B错误;
C、丙、丁相比浓度相同,温度相同,则达到平衡时,容器丁中的正反应速率等于容器丙中的,故C错误;
D、甲、丙相比,丙中浓度为甲的2倍,且增大压强平衡正向移动,则达到平衡时,容器丙中c( SO3)大于容器甲中c(SO3)的两倍,故D正确;
答案选AD。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目