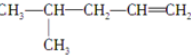题目内容
8.关于丙烯醇(CH2=CH-CH2OH),下列说法正确的是( )| A. | 它不能使酸性高锰酸钾溶液褪色 | B. | 它能发生加成反应和酯化反应 | ||
| C. | 它不能与金属钠反应 | D. | 它不能发生氧化反应 |
分析 CH2=CH-CH2OH含有碳碳双键,可发生加成、加聚、氧化反应,含有-OH,可发生取代、氧化、消去反应,以此解答该题.
解答 解:A.含有碳碳双键,可被酸性高锰酸钾氧化,故A错误;
B.含有碳碳双键,可发生加成反应,含有羧基,可发生酯化反应,故B正确;
C.含有羧基,可与钠反应生成氢气,故C错误;
D.含有碳碳双键,可发生氧化反应,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,题目难度不大,注意把握有机物官能团的性质,为解答该题的关键.

练习册系列答案
相关题目
18.下表为元素周期表中某一周期元素的原子结构示意图.
请回答下列问题:
(1)表中磷原子的核电荷数x=15.
(2)表中具有相对稳定结构的元素是氩元素.
(3)镁元素与氯元素形成的化合物的化学式为MgCl2.
(4)上述元素在周期表中处于同一周期的原因是原子核外电子层数相同.
(5)在化学反应中,每个铝原子失去3个电子形成铝离子.
(6)硫与氧气反应的化学方程式是:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;设N个氧气分子的质量为32g,则64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.
| 元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
| 元素符号 | Na | Mg | Al | Si | p | S | Cl | Ar |
| 原子结构 示意图 |  | 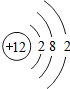 | 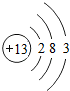 | 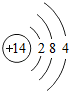 | 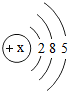 | 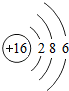 | 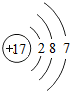 |  |
(1)表中磷原子的核电荷数x=15.
(2)表中具有相对稳定结构的元素是氩元素.
(3)镁元素与氯元素形成的化合物的化学式为MgCl2.
(4)上述元素在周期表中处于同一周期的原因是原子核外电子层数相同.
(5)在化学反应中,每个铝原子失去3个电子形成铝离子.
(6)硫与氧气反应的化学方程式是:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;设N个氧气分子的质量为32g,则64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.
19.下列各组离子,在溶液中可以大量共存的是( )
| A. | OH-、SO${\;}_{4}^{2-}$、H+、Ba2+ | B. | Cl-、NO${\;}_{3}^{-}$、Ba2+、Ag+ | ||
| C. | H+、Na+、Cl-、CO${\;}_{3}^{2-}$ | D. | Na+、SO${\;}_{4}^{2-}$、K+、Cl- |
16.下列说法正确的是( )
| A. | HCl、NaOH、BaSO4均属于电解质 | B. | CuSO4•5H2O属于混合物 | ||
| C. | 凡能电离出H+的化合物均属于酸 | D. | 盐类物质一定含有金属阳离子 |
3.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 32gO2中含有的分子数为NA | |
| B. | 标准状况下,22.4L H2O中含有的分子数为NA | |
| C. | 1mol Mg与足量O2反应转移的电子数为NA | |
| D. | 1L 1mol•L-1 CaCl2溶液中含有的氯离子数为NA. |
13.以下是鉴别食盐水与蔗糖水的方法,其中在实验室中进行的正确鉴别方法是( )
| A. | 向两种溶液中分别加入少量稀H2SO4并加热,再加NaOH中和H2SO4,再加入银氨溶液微热 | |
| B. | 测溶液的导电性 | |
| C. | 将溶液与溴水混合,振荡 | |
| D. | 用舌头尝味道 |
17.同温同压下,甲容器中装有56gN2,乙容器中装有16gCH4,则甲、乙两容器的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |