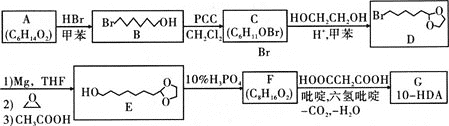
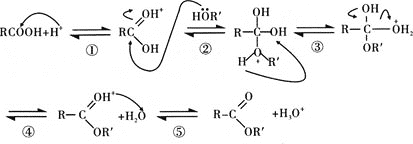
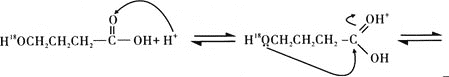题目内容
【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。学习物质结构与性质,回答下列问题:
(1)太阳中的主要化学元素是氢和_______。
(2)氢负离子H-基态电子排布式为_______。
(3)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子H-的第一电离能为________。
(4)几种碱金属氢化物的部分性质如下表所示:
氢化物 | LiH | NaH | KH |
密度/g/cm3 | 0.78 | 1.43 | |
分解温度/℃ | 850 | 425 | 400 |
从化学结构的角度回答说明,分解温度LiH>NaH>KH___。
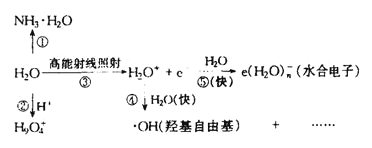
(5)水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中,中心原子的杂化类型是___,请画出H5O2+的结构式:______。当用高能射线照射液态水时,水分子便以一种新的方式电离,如图所示写出高能射线照射水的总反应的离子方程式_______。
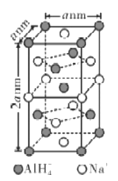
(6)氢化铝钠(NaAlH4)等复合氢化物是重要的有机还原剂。NaAlH4晶胞结构如图所示,NaAlH4晶体中,与Na+紧邻且等距的A1H4-有___个,设阿伏伽德罗常数为NA,则晶体的密度为___g·cm-3。
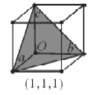
(7)在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如图则该立方晶胞体中(1,1,1)晶面共有___个。
【答案】氦 1s2 73kJ/mol 均为离子晶体,阳离子离子半径Li+<Na+<K+,晶格能LiH>NaH>KH,离子键强,分解温度高 sp3 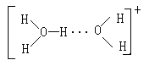 (n+2)H2O
(n+2)H2O![]() e(H2O)n-+·OH+H3O+ 8
e(H2O)n-+·OH+H3O+ 8 ![]() 8
8
【解析】
(1)根据太阳中各种元素含量多少分析判断;
(2)H-核外有有2个电子,根据核外电子排布规律书写;
(3)根据第一电离能定义推断;
(4)从离子半径、晶格能大小分析;
(5)根据杂化轨道理论分析,H5O2+可看作是H3O+与H2O通过氢键形成的离子;据此判断微粒的空间构型;结合图示书写反应方程式;
(6)以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,晶胞中AlH4-数目为1+8×![]() +4×
+4×![]() =4,Na+数目为6×
=4,Na+数目为6×![]() +4×
+4×![]() =4,则二者配位数相等;结合晶胞中AlH4-、Na+数目,表示出晶胞质量,再根据ρ=
=4,则二者配位数相等;结合晶胞中AlH4-、Na+数目,表示出晶胞质量,再根据ρ=![]() 计算密度;
计算密度;
(7)根据该(1,1,1)晶面中在上下两个面上的位置及个数分析;
(1)太阳上含量最丰富的元素是氢,其次是氦元素,故太阳中的主要化学元素是氢和氦;
(2)H原子核内只有1个质子,氢负离子H-核外有2个电子,基态电子排布式为1s2;
(3)H-(g)=H(g)+e-吸收的能量为73kJ/mol,则氢负离子H-的第一电离能为73kJ/mol。
(4)LiH、NaH、KH三种晶体均为离子晶体,由于离子核外电子层数越多,离子半径越大,阳离子的离子半径:Li+<Na+<K+,离子半径越大,与H-结合形成的离子键就越弱,晶格能就越小,所以晶格能LiH>NaH>KH,晶格能越大,离子键就越强,晶体分解温度就越高,所以分解温度LiH>NaH>KH;
(5) H3O+中,中心O原子的杂化类型是sp3杂化;H5O2+可看作是H3O+与H2O通过氢键形成的离子,所以H5O2+的结构式是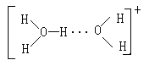 ;
;
根据图示可得高能射线照射水的总反应的离子方程式为:(n+2)H2O![]() e(H2O)n-+·OH+H3O+;
e(H2O)n-+·OH+H3O+;
(6)以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,晶胞中AlH4-数目为1+8×![]() +4×
+4×![]() =4,Na+数目为6×
=4,Na+数目为6×![]() +4×
+4×![]() =4,则与Na+紧邻且等距的AlH4-有8个;晶胞质量=4×
=4,则与Na+紧邻且等距的AlH4-有8个;晶胞质量=4×![]() g,晶胞密度为
g,晶胞密度为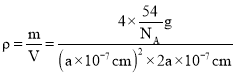 =
=![]() g/cm3;
g/cm3;
(7)在该(1,1,1)晶面中,该平面通过上面一个顶点,下面2个顶点形成一个(1,1,1)晶面,上面共有4个这样顶点,可形成4个这样晶面;同样,若该晶面通过上面2个顶点,下面一个顶点,也可以形成4个这样的晶面,因此共可以形成8个这样晶面。

 名校课堂系列答案
名校课堂系列答案