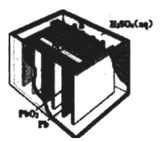
题目内容
【题目】25℃时,将浓度均为0.1 molL-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=l00mL,Va、Vb与混合液的pH的关系如图所示。 下列说法正确的是

A. Ka(HA)=10-6mol·L-1
B. b点时,c(B+)=c(A-)=c(H+)=c(OH-)
C. c点时, 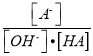 随温度升高而减小
随温度升高而减小
D. a→c过程中水的电离程度始终增大
【答案】C
【解析】A.由图示可知0.1 molL-1、的HA溶液pH=3,则Ka(HA)= 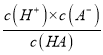 =
=![]() =10-5mol·L-1,故A错误;B.b点时溶液显中性,此时c(B+)=c(A-)>c(H+)=c(OH-),故B错误;C.c点时,溶液中存在A-的水解,且加热促进水解,水解平衡常数Kh增大,则
=10-5mol·L-1,故A错误;B.b点时溶液显中性,此时c(B+)=c(A-)>c(H+)=c(OH-),故B错误;C.c点时,溶液中存在A-的水解,且加热促进水解,水解平衡常数Kh增大,则 随温度升高而减小,故C正确;D.a点为HA的溶液,酸的电离抑制水的电离,而b点为BA溶液因水解促进水的电离,c点溶液中过量的BOH电离抑制水的电离,则a→c过程中水的电离程度先增大后减小,故D错误;答案为C。
随温度升高而减小,故C正确;D.a点为HA的溶液,酸的电离抑制水的电离,而b点为BA溶液因水解促进水的电离,c点溶液中过量的BOH电离抑制水的电离,则a→c过程中水的电离程度先增大后减小,故D错误;答案为C。

【题目】煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为﹣285.8kJ/mol、﹣283.0kJ/mol和﹣726.5kJ/mol.请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:______________________________.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度/℃ | 250 | 300 | 350 | |
K/L2mol﹣2 | 2.041 | 0.270 | 0.012 |
①该反应的平衡常数的表达式是____________,由表中数据判断△H__0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为______,则反应速率v(H2)=_______.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的![]() ,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)._______.
,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)._______.

(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式__________________.