题目内容
【题目】根据已学物质结构与性质的有关知识,回答下列问题:
(1)某元素被科学家称之为人体微量元素中的“防癌之王”,其基态原子的外围电子排布是4s24p4,该元素的名称是____________。
(2)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种,该周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但是30Zn与31Ga的第一电离能不符合这一规律,原因是________________________________________。
(3)AsH3中心原子的杂化类型为________;一定压强下将AsH3、NH3、PH3的混合气体降温时首先液化的是________,理由是______________________________________。
(4)配合物Fe(CO)5的配位体是________;常温下,Fe(CO)5为黄色液体,熔点为251 K,沸点为376 K,据此,可判断Fe(CO)5晶体属于________晶体。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为____________;已知两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为_______。

【答案】 硒 3 30Zn的4s能级有2个电子,处于全满状态,较稳定 sp3杂化 NH3 NH3分子之间有氢键,沸点较高 CO 分子 1∶2 3![]() :8
:8
【解析】(1)某基态原子的外围电子排布是4s24p4,原子序数等于34,因此该元素的名称是硒;(2)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有K、Cr、Cu,共计是3种。由于30Zn的4s能级有2个电子,处于全满状态,较稳定,因此第一电离能大于31Ga的。(3)AsH3中心原子As的价层电子对数=3+(5-3×1)/2=4,所以杂化类型为sp3杂化;由于NH3分子之间有氢键,沸点较高,因此一定压强下将AsH3、NH3、PH3的混合气体降温时首先液化的是NH3。(4)配合物Fe(CO)5中铁含有空轨道,配位体是CO;常温下,Fe(CO)5为黄色液体,熔点为251 K,沸点为376 K,熔沸点较低,这说明Fe(CO)5晶体属于分子晶体。(5)体心立方晶胞中铁原子个数=1+8×1/8=2;面心立方晶胞中实际含有的Fe原子个数=6×1/2+8×1/8=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比1:2;
设体心立方中晶胞的棱长为x,铁原子的直径为A,则3x2=(2A)2,解得x= ![]() ;铁原子直径=A,所以其晶胞体积=R3,面心立方中晶胞的对角线为2A,则其边长=
;铁原子直径=A,所以其晶胞体积=R3,面心立方中晶胞的对角线为2A,则其边长= ![]() ,其晶胞体积=
,其晶胞体积=![]() 。体心立方的密度与面心立方的密度之比=
。体心立方的密度与面心立方的密度之比=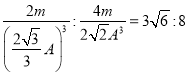 。
。

 培优三好生系列答案
培优三好生系列答案


