题目内容
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中第 周期 族,与N3-含有相同电子数的三原子分子的空间构型是 。
(2)C、N、O三种元素的第一电离能由大到小的顺序为
(3)Cu+电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu20,试从结构角度解释高温下CuO何会生成Cu2O: 。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是 ,乙醛分子中H—C—O的键角 (填“大于”“等于”或“小于”)乙醇分子中的H—C一0的键角。
(5)[Cu(H20)4]2+为平面正方形结构,其中的两个H20被Cl-取代有两种不同的结构,试画出[Cu(H20)2(C1)2]具有极性的分子的结构式: 。
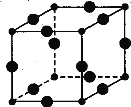
(6)Cu3N的晶胞结构如图,N3-的配位数为 ,Cu+半径为a pm,N3- 半径为b pm,Cu3N的密度为 g·cm-3。(阿伏加德罗常数用NA表示)
【答案】(1)二 VA V形 (2)N>O>C (3)1s22s22p6 3s23p63d10
Cu+价电子排布式为3d10,为全充满结构,更稳定
(4)sp2、sp3 大于 (5) (6)6
(6)6 ![]()
【解析】
试题分析:(1)N元素位于元素周期表中第二周期第VA族;N3-中的电子数是10个,所以与N3-含有相同电子数的三原子分子是水分子,水分子的空间构型是V型;
(2)同周期元素随核电荷数的增大,第一电离能逐渐增大,但N原子的2p轨道为半充满的稳定状态,所以N的第一电离能大于O,所以C、N、O的第一电离能的大小顺序是N>O>C;
(3)Cu+的核外有28个电子,最外层的4s1电子失去,所以电子排布式为1s22s22p6 3s23p63d10;CuO中Cu为+2价,而+1价Cu价电子排布式为3d10,为全充满结构,更稳定;
(4)乙醛的结构简式我CH3CHO,甲基的C原子周围的化学键都是单键,是sp3杂化,而醛基中的C原子存在双键,所以是sp2杂化;乙醇分子中与醛基相连的C原子也是sp3杂化,受孤对电子的影响,所以sp2杂化的键角大于sp3杂化的键角;
(5)[Cu(H20)4]2+为平面正方形结构,其中的两个H20被Cl-取代且具有极性的分子不是中心对称分子,所以该分子的结构为 ;
;
(6)根据原子半径的大小,打球代表Cu原子,小球代表N,N3-的配位数为6,同层为4个,上下各一个;该晶胞中Cu原子的个数是12×1/4=3,N原子的个数是8×1/8=1,晶胞的体积是[(2a+2b)×10-10cm]3,晶胞质量是(3×64+14)/NA,所以晶胞的密度=m/V=206/8(a+b)3×10-30×NA g·cm-3=103×1030/4(a+b)3 NA g·cm-3。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案