题目内容
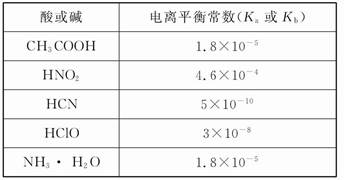
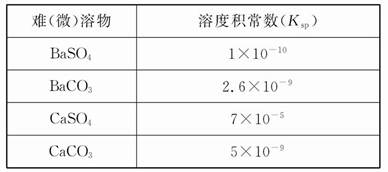
Ⅰ.已知:H2A的A2-可表示S2-、S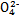 、S
、S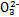 、Si
、Si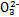 或C
或C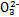 等离子。
等离子。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
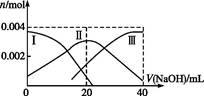
①当V(NaOH)="20" mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
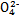 、S
、S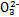 、Si
、Si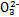 或C
或C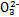 等离子。
等离子。(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:

①当V(NaOH)="20" mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O
 H++OH- KW=10-14
H++OH- KW=10-14CH3COOH
 H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a
 b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。 Ⅰ.(1)①c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) ②小 碱 (2)10-13
Ⅱ.(3)Kh=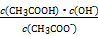 5.6×10-10
5.6×10-10
增大 (4)小于 大于
Ⅲ.(5)大于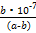 mol·L-1
mol·L-1
Ⅱ.(3)Kh=
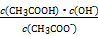 5.6×10-10
5.6×10-10增大 (4)小于 大于
Ⅲ.(5)大于
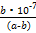 mol·L-1
mol·L-1Ⅰ.(1)混合溶液为NaHA,由图像可知c(H2A)<c(A2-),所以HA-电离程度大于水解程度,溶液显酸性,所以抑制水的电离;(2)1×10-2=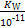 ;Ⅱ.(4)水解程度随浓度的增大而减小,所以a大于b。Ⅲ.(5)首先写出电离平衡常数表达式
;Ⅱ.(4)水解程度随浓度的增大而减小,所以a大于b。Ⅲ.(5)首先写出电离平衡常数表达式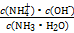 ,然后依据电荷守恒可知溶液中c(N
,然后依据电荷守恒可知溶液中c(N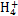 )=c(Cl-)= mol·L-1,依据物料守恒可知溶液中c(NH3·H2O)= mol·L-1-c(N
)=c(Cl-)= mol·L-1,依据物料守恒可知溶液中c(NH3·H2O)= mol·L-1-c(N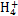 )=
)=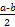 mol·L-1,c(OH-)=10-7 mol·L-1,代入即可。
mol·L-1,c(OH-)=10-7 mol·L-1,代入即可。
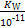 ;Ⅱ.(4)水解程度随浓度的增大而减小,所以a大于b。Ⅲ.(5)首先写出电离平衡常数表达式
;Ⅱ.(4)水解程度随浓度的增大而减小,所以a大于b。Ⅲ.(5)首先写出电离平衡常数表达式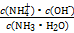 ,然后依据电荷守恒可知溶液中c(N
,然后依据电荷守恒可知溶液中c(N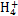 )=c(Cl-)= mol·L-1,依据物料守恒可知溶液中c(NH3·H2O)= mol·L-1-c(N
)=c(Cl-)= mol·L-1,依据物料守恒可知溶液中c(NH3·H2O)= mol·L-1-c(N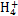 )=
)=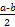 mol·L-1,c(OH-)=10-7 mol·L-1,代入即可。
mol·L-1,c(OH-)=10-7 mol·L-1,代入即可。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目