题目内容
13.设NA为阿伏加德罗常数.下列叙述中正确的是( )| A. | 10g H${\;}_{2}^{18}$O中所含的中子数为4NA | |
| B. | 1mol苯分子中含有的碳碳双键数为3NA | |
| C. | 标准状况下,22.4LCl2完全反应,转移的电子数一定是2NA | |
| D. | 常温下,1L0.1mol/L Na2CO3溶液中的阴离子总数大于0.1NA |
分析 A、10g H${\;}_{2}^{18}$O的物质的量为$\frac{10g}{20g/mol}$=0.5mol,一个 H${\;}_{2}^{18}$O分子含有10个中子;
B、苯中不含碳碳双键;
C、1mol氯气与足量氢氧化钠溶液反应转移电子数为NA;
D、碳酸根离子水解,阴离子数目增多.
解答 解:A、10g H${\;}_{2}^{18}$O的物质的量为$\frac{10g}{20g/mol}$=0.5mol,一个 H${\;}_{2}^{18}$O分子含有10个中子,因此10g H${\;}_{2}^{18}$O中含有5NA个中子,故A错误;
B、苯中不含碳碳双键,故B错误;
C、标准状况下,22.4LCl2为1mol,1mol氯气与足量氢氧化钠溶液反应转移电子数为NA,故C错误;
D、1L0.1mol/L Na2CO3溶液中,碳酸根离子为0.1mol,碳酸根离子水解,阴离子数目增多,故阴离子总数大于0.1NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数,涉及化学键、转移电子数、中子数的计算,明确有机物的结构和分子所含中子数、电子数、转移电子数是解题的关键.

练习册系列答案
相关题目
8.某反应的化学方程式为:aFeCl2+bKNO3+cHCl═dFeCl3+eKCl+fX+gH2O,若b=1,d=3,则X的化学式为( )
| A. | N2 | B. | NO | C. | NO2 | D. | NH4Cl |
18.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法正确的是( )
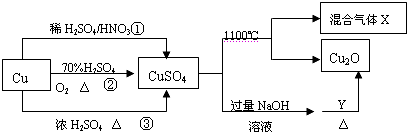

| A. | 1mol CuSO4在1100℃所得混合气体X中O2可能为0.75mol(X的组成为SO2、SO3、O2) | |
| B. | 相对于途径①、②,途径③更好地体现了绿色化学理念 | |
| C. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| D. | Y一定是葡萄糖 |
5.下列电子排布式中,原子处于激发态的是( )
| A. | 1s22s22p1 | B. | 1s22s22p33s1 | ||
| C. | 1s22s22p63s23p63d104s2 | D. | 1s22s22p63s23p63d34s2 |
15.元素在元素周期表中的位置可以反映元素的原子结构和性质,下列说法正确的是( )
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期中同主族元素的最外层电子数及化学性质完全相同 | |
| D. | 同周期元素的原子半径从左到右依次减小 |
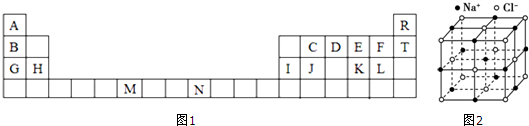
16.下表列出了A~R十二种元素在周期表中的位置:
请用相应的化学符号和化学用语回答下列问题:
(1)其中化学性质最不活泼的是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为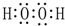 .
.
(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)E和J形成原子个数比为1:3化合物的结构简式CH3CH3,该物质与G的单质在一定条件下发生取代反应生成的二取代产物有2种.
(5)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(6)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为_离子键、共价键.
(7)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(8)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
(1)其中化学性质最不活泼的是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为
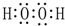 .
.(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)E和J形成原子个数比为1:3化合物的结构简式CH3CH3,该物质与G的单质在一定条件下发生取代反应生成的二取代产物有2种.
(5)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(6)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为_离子键、共价键.
(7)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(8)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
 .
.
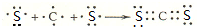 .
.