题目内容
1.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D元素与B元素的质量比为7:8;E元素与B元素的质量比为1:1.试回答:(1)写出D原子的电子排布式1s22s22p63s23p2.
(2)用电子式表示AE2的形成过程
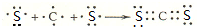 .
.(3)B、C两元素的第一电离能较大的元素是:N(填写元素符号).
(4)C的氢化物的VSEPR模型为正四面体,中心原子C的轨道杂化类型为sp3.
(5)C的单质分子中π键的数目为2,B、D两元素的气态氢化物的稳定性大小关系为:H2O>SiH4(填写化学式).
(6)由元素D组成的单质晶体中,与某个D原子距离最近的D原子有4个;1molD的氧化物晶体中,含D-O键的数目4×6.02×1023.
分析 A原子最外层p能级的电子数等于次外层的电子数总数,p能级电子数不超过6,则A的核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,即位于第二周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,故B为O元素,B元素可分别与A、C、D、E生成RB2型化合物,则C为N元素,可形成NO2化合物;在DB2中D与B的质量比为7:8,则有M(D):2M(O)=7:8,则M(D)=28,故D为Si元素;在EB2中E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,据此解答.
解答 解:A原子最外层p能级的电子数等于次外层的电子数总数,p能级电子数不超过6,则A的核外电子排布为1s22s22p2,故A为碳元素;A、B、C属于同一周期,即位于第二周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,故B为O元素,B元素可分别与A、C、D、E生成RB2型化合物,则C为N元素,可形成NO2化合物;在DB2中D与B的质量比为7:8,则有M(D):2M(O)=7:8,则M(D)=28,故D为Si元素;在EB2中E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素.
(1)D为Si元素,原子序数为14,基态原子的核外电子排布式为1s22s22p63s23p2,故答案为:1s22s22p63s23p2;
(2)AE2为CS2,为共价化合物,各原子最外层满足8电子稳定结构,用电子式表示的形成过程为: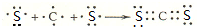 ,
,
故答案为: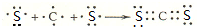 ;
;
(3)由于N原子2p轨道为半充满状态,能量较大,第一电离能较大,所以第一电离能N>O,故答案为:N;
(4)C的氢化物为NH3,N原子与H原子形成3个δ键,孤电子对数为$\frac{5-1×3}{2}$=1,价层电子对数为4,VSEPR模型为正四面体,杂化轨道数目为4,N原子的杂化轨道类型为sp3杂化,
故答案为:正四面体;sp3;
(5)C为N元素,形成的单质为N≡N,含有2个π键,由于O的非金属性大于Si,则稳定性:H2O>SiH4,
故答案为:2;H2O;SiH4;
(6)由元素Si组成的单质晶体中,Si原子与周围4个Si原子形成Si-Si,与某个Si原子距离最近的Si原子有4个;二氧化硅晶体中Si原子形成4个Si-O,1mol二氧化硅具有中4molSi-O价,含Si-O键的数目4×6.02×1023,
故答案为:4;4×6.02×1023.
点评 本题是对物质结构的考查,涉及核外电子排布、电子式表示共价化合物形成、价层电子对数理论、杂化发生判断、化学键、晶胞结构等,推断元素是解题关键,注意理解掌握同周期第一电离能异常原因.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 煤干馏 | B. | 石油的减压分馏 | C. | 石油裂解 | D. | 煤液化 |
①SiO2→Na2SiO3
②Al(OH)3-→Al2O3
③SiO2→H2SiO3
④Al2O3-→Al(OH)3
⑤Na2O2→NaCl
⑥Al-→AlO2-.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ⑤⑥ |
| A. | 产物的平均摩尔质量为24 g/mol | |
| B. | 若将产物通过浓硫酸充分吸收后恢复至(101 kPa,120℃),则压强变为原来的$\frac{1}{3}$ | |
| C. | 反应中消耗的氧气为56 g | |
| D. | 若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收 |
①猜想:
因素一:银氨溶液的pH大小;
因素二:反应(水浴)的温度.
②你设计实验验证上述“因素一”,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验 步骤 | 实验操作 | 预期现象及结论 (步骤1只写现象) |
| 1 | 在A、B两支洁净的试管中各加入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水, 至沉淀恰好溶解,此时制得pH均约为8的银氨溶液. | 先生成白色沉淀,后沉淀溶解. |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加1滴NaOH溶液;振荡后将两支试管放在热水浴中温热. | 若A试管比B试管出现的银镜时间短、光亮,则则溶液pH大,反应速率快; 若A试管比B试管出现的银镜时间长,则则溶液pH大,反应速率慢. |
| A. | 10g H${\;}_{2}^{18}$O中所含的中子数为4NA | |
| B. | 1mol苯分子中含有的碳碳双键数为3NA | |
| C. | 标准状况下,22.4LCl2完全反应,转移的电子数一定是2NA | |
| D. | 常温下,1L0.1mol/L Na2CO3溶液中的阴离子总数大于0.1NA |
| A. | 丁硫醇、甲硫醇与乙硫醇互为同系物 | |
| B. | 沸点不同的丁硫醇有四种 | |
| C. | 丁硫醇在空气中燃烧生成二氧化碳、二氧化硫和水 | |
| D. | 在水溶液中,乙硫醇比乙醇更难电离出H+离子 |