题目内容
(8分)在中和滴定中,稀盐酸是常用的滴定剂,而盐酸标准溶液的浓度又常常是以氢氧化钠作基准物质标定的,某学生为此进行如下操作:?
a.用蒸馏水分别洗净酸式滴定管和锥形瓶,并排出滴定管尖嘴部位的气泡;?
b.用待标定盐酸润洗滴定管内壁3次(每次用量2~3 mL);?
c.向滴定管内注入待标定盐酸,记录管内液面所在刻度V1 mL;?
d.将准确称取的W g干燥的NaOH放入锥形瓶中,加25 mL蒸馏水,振荡使之溶解;?
e.滴入1滴酚酞指示剂;?
f.在锥形瓶下铺一张白纸,向瓶内滴加待标定的盐酸,边滴边摇动锥形瓶,直到溶液的红色刚好褪去,并不再变红,即为滴定终点;?
g.记录滴定管内液面所在刻度V2 mL。?
(1)若该生操作无误,则所标定盐酸的物质的量浓度为 。?
(2)在进行滴定操作时,操作者的眼睛应注视 。?
(3)若该生在溶解固体氢氧化钠时,用了28 mL蒸馏水,则所标定盐酸的浓度值将
(填“偏高”、“偏低”、“无影响”)。?
(4)若该生记录滴定管内液面所在刻度时,滴定前是仰视读数,达滴定终点是平视读数,则所标定盐酸的浓度值将 (填“偏高”、“降低”、“无影响”)。
a.用蒸馏水分别洗净酸式滴定管和锥形瓶,并排出滴定管尖嘴部位的气泡;?
b.用待标定盐酸润洗滴定管内壁3次(每次用量2~3 mL);?
c.向滴定管内注入待标定盐酸,记录管内液面所在刻度V1 mL;?
d.将准确称取的W g干燥的NaOH放入锥形瓶中,加25 mL蒸馏水,振荡使之溶解;?
e.滴入1滴酚酞指示剂;?
f.在锥形瓶下铺一张白纸,向瓶内滴加待标定的盐酸,边滴边摇动锥形瓶,直到溶液的红色刚好褪去,并不再变红,即为滴定终点;?
g.记录滴定管内液面所在刻度V2 mL。?
(1)若该生操作无误,则所标定盐酸的物质的量浓度为 。?
(2)在进行滴定操作时,操作者的眼睛应注视 。?
(3)若该生在溶解固体氢氧化钠时,用了28 mL蒸馏水,则所标定盐酸的浓度值将
(填“偏高”、“偏低”、“无影响”)。?
(4)若该生记录滴定管内液面所在刻度时,滴定前是仰视读数,达滴定终点是平视读数,则所标定盐酸的浓度值将 (填“偏高”、“降低”、“无影响”)。
(1)W/40(V2-V1) mol·L-1 (2)锥形瓶中溶液颜色变化 (3)无影响
(4)偏高?
(4)偏高?
试题分析:1、根据盐酸与氢氧化钠反应的化学方程式可知,反应消耗盐酸与氢氧化钠物质的量之比为1:1,即消耗的盐酸物质的量等于消耗氢氧化钠物质的量(W/40),W/40=(V2
-V1 )C C= W/40(V2-V1) mol·L-1
2进行滴定操作时,操作者的眼睛应注视锥形瓶中溶液颜色变化.
3若该生在溶解固体氢氧化钠时,用了28 mL蒸馏水,则所标定盐酸的浓度值将无影响,因为定容的时候也要加水。
4、若该生记录滴定管内液面所在刻度时,滴定前是仰视读数,使得读数偏大,达滴定终点是平视读数,则所测出的氢氧化钠体积偏小,则所标定盐酸的浓度值将偏高
点评:本题属于中等题,难度不大,主要考察了溶液的配制及其操作,掌握读数时仰视和俯视对读数的影响使解题的关键。

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
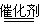 2CO2+N2
2CO2+N2 2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果 实验数据
实验数据