题目内容
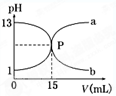
25℃时,用水稀释pH=13氨水至体积为原来的100倍,下列变化正确的是
| A.OH-物质的量不变 | B.稀释后溶液pH=11 |
| C.c(H+)和c(OH-)的乘积变小 | D.c(OH-)/c(NH3·H2O)的值变大 |
D
试题分析:c(OH-)/c(NH3·H2O)的值变大,因为电离平衡中,分子变大,分母变小。故选D。
点评:强碱pH下降得快。因为强碱是强电解质,始终完全电离。用水稀释pH=13氨水至体积为原来的100倍时,OH-浓度下降了,但平衡朝着电离方向移动,所以补偿了一部分OH-,所以OH-要略多于原来的1/100,所以pH>11。

练习册系列答案
相关题目
 =10-12,将这两种溶液等体积混合,所得溶液各离子物质的量浓度关系不正确的是( )
=10-12,将这两种溶液等体积混合,所得溶液各离子物质的量浓度关系不正确的是( )