题目内容
已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
B
Mg(OH)2的溶度积小,故其电离出的Mg2+浓度要小一些,A错;N可以结合Mg(OH)2电离出的OH-,从而促使Mg(OH)2的电离平衡正向移动,c(Mg2+)增大,B正确。Ksp仅与温度有关,故C错;D项,由于MgF2的溶度积更小,所以沉淀会向更难溶的方向进行,即可以生成MgF2沉淀,正确。

练习册系列答案
相关题目
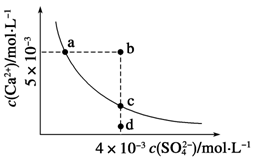
 )一定等于3×10-3 mol·L-1
)一定等于3×10-3 mol·L-1 Ca(OH)2(aq)
Ca(OH)2(aq) Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小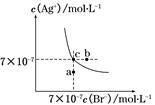
 AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816