题目内容
【题目】把200mL含有BaCl2和KCl的混合溶液分成2等份,一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
A.0.1(b-2a)B.10(2a-b)C.10(b-a)D.10(b-2a)
【答案】D
【解析】
混合溶液分成两等份,每份溶液浓度相同.一份加入含amol硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=n(Na2SO4);
另一份加入含bmol硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+),再利用电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl-),据此计算每份中n(K+),根据c=![]() 计算钾离子浓度。
计算钾离子浓度。
根据上述分析可知,每份溶液中![]() ,故钾离子浓度为
,故钾离子浓度为![]() ,D项正确;
,D项正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】化工原料异丁烯(C4H8)可由异丁烷(C4H10)直接催化脱氢制备:C4H10(g) ![]() C4H8(g) + H2(g)ΔH=+139 kJ/mol
C4H8(g) + H2(g)ΔH=+139 kJ/mol
(1)该反应的化学平衡常数的表达式为_________________。
(2)一定条件下,以异丁烷为原料生产异丁烯。温度、压强改变对异丁烷平衡转化率的
影响如下图所示。
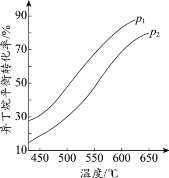
①判断p1、p2的大小关系:p1_________________(填“>”或“<”)p2,理由是_________________。
②若异丁烷的平衡转化率为40%,则平衡混合气中异丁烯的物质的量分数最多为______%(保留小数点后1位)。
(3)目前,异丁烷催化脱氢制备异丁烯的研究热点是催化活性组分以及载体的选择。下表是以V-Fe-K-O为催化活性物质,反应时间相同时,测得的不同温度、不同载体条件下的数据。
温度/℃ | 570 | 580 | 590 | 600 | 610 | |
以γ-Al2O3为载体 | 异丁烷转化率/% | 36.41 | 36.49 | 38.42 | 39.23 | 42.48 |
异丁烯收率/% | 26.17 | 27.11 | 27.51 | 26.56 | 26.22 | |
以TiO2为载体 | 异丁烷转化率/% | 30.23 | 30.87 | 32.23 | 33.63 | 33.92 |
异丁烯收率/% | 25.88 | 27.39 | 28.23 | 28.81 | 29.30 | |
说明:收率=(生产目标产物的原料量/原料的进料量)×100%
①由上表数据,可以得到的结论是____________(填字母序号)。
a.载体会影响催化剂的活性
b. 载体会影响催化剂的选择性
c.载体会影响化学平衡常数
②分析以γ-Al2O3为载体时异丁烯收率随温度变化的可能原因:___________。