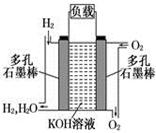
题目内容
(16分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:

请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式)。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
。
(3)析出CuCl晶体时的最佳pH在 左右。
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
(5)从滤液A中可回收的主要物质是 (写化学式)。
(6)以碳棒为电极电解CuCl2溶液可得到CuCl。写出电解CuCl2溶液后的阴极上发生的反应为
(16分)
(1)Cu(OH)2 Fe(OH)3 (每个2分,共4分)
(2)2Cu2++2Cl—+Fe=2CuCl↓+Fe2+(3分,没配平扣1分,无写“↓”不扣分)
(3)3 (2分,写“2.8~3.5”均得分)
(4)促使乙醇和水的挥发,防止CuCl被空气氧化 (2分,写对其中的一点得2分)
(5)Na2SO4和FeSO4(2分;写对其中一个得2分)
(6)Cu2++Cl-+e-===CuCl↓ (3分,无写“↓”扣1分)
解析试题分析:(1)酸性电镀废液主要含Cu2+、Fe3+,加碱后生成Cu(OH)2 Fe(OH)3,是电镀污泥的主要成分;
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl,同时还有氯化亚铁、硫酸钠生成,离子方程式为2Cu2++2Cl—+Fe=2CuCl↓+Fe2+
(3)由图可知pH=3时CuCl的产率最高,所以析出CuCl晶体时的最佳pH在3左右;
(4)真空干燥时无氧气存在,密封包装也是隔绝氧气,所以真空干燥,密封包装的目的是促使乙醇和水的挥发,防止CuCl被空气氧化;
(5)由流程图可知,氢氧化铁与氢氧化铜与酸反应后生成硫酸铜与硫酸铁,加入铁粉后,溶液中存在硫酸亚铁,氯化亚铜析出后溶液中只剩硫酸亚铁与原来加碱时生成的硫酸钠,所以从滤液A中可回收的主要物质是Na2SO4和FeSO4;
(6)电解池中阴极发生还原反应,元素化合价降低,CuCl2中Cu是+2价,CuCl中Cu是+1价,所以阴极上发生的反应是Cu2++Cl-+e-===CuCl↓。
考点:考查物质制备,工业流程的分析,电化学原理的应用

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案(11分)
(1)海水中的钠盐、镁盐等都是重要的化工原料,从海水中提取铀、重水对一个国家来说具有战略意义。
①写出氯化镁的电子式__________________________
②重水的摩尔质量为____________________________
③写出金属镁的工业冶炼方程式__________________________________________
④海水淡化的常见方法有电渗析法、离子交换法、_________________
(2)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。
①乙烯和氯化氢在一定条件下反应的化学方程式是____________________________
②决定氯乙烷能用于冷冻麻醉应急处理的具体性质是________(填选项)
| A.沸点低 | B.沸点高 | C.易挥发 | D.难挥发 |
(3)“可燃冰”是天然气与水相互作用形成的晶体物质,若把“可燃冰”(用甲烷表示)燃烧在一定条件下改装成原电池,则在原电池的负极发生反应的物质是
(6分)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或 负 )。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |