题目内容
已知锌溶于稀硝酸中可发生如下反应:4Zn+10HNO3==4Zn(NO3)2+N2O↑+5H2O,该反应中被还原的硝酸与未被还原的硝酸的质量比是
| A.2∶5 | B.1∶4 | C.4∶1 | D.5∶1 |
B
试题分析:此反应中元素的化合价变化情况为:
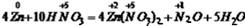 ,即参加反应的10个HNO3中的+5价N,反应生成了4个Zn(NO3)2中+5价的N,即化合价未发生变化,又生成了1个N2O中的+1价的N,化合价降低被还原,故从生成的4个Zn(NO3)2中可看出有8各+5价N未变化,生成1各N2O中有2个+5价生成了2个+1价的N,故被还原的HNO3是2,即得被还原的HNO3和未被还原的HNO3的个数比是2:8,即1:4,因此得被i还原的HNO3和未被还原的HNO3的质量比是:(1*63):(4*63)=1:4。
,即参加反应的10个HNO3中的+5价N,反应生成了4个Zn(NO3)2中+5价的N,即化合价未发生变化,又生成了1个N2O中的+1价的N,化合价降低被还原,故从生成的4个Zn(NO3)2中可看出有8各+5价N未变化,生成1各N2O中有2个+5价生成了2个+1价的N,故被还原的HNO3是2,即得被还原的HNO3和未被还原的HNO3的个数比是2:8,即1:4,因此得被i还原的HNO3和未被还原的HNO3的质量比是:(1*63):(4*63)=1:4。故选B。
点评:本题考查的是有关硝酸的氧化性的相关知识,解答此题需要学生能正确的分析出化学反应中元素化合价的变化情况。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
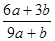
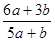
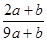
 混合,恰好能被水完全吸收,则a和b的关系可能是
混合,恰好能被水完全吸收,则a和b的关系可能是 .3a
.3a