题目内容
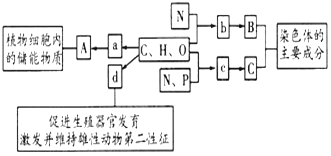
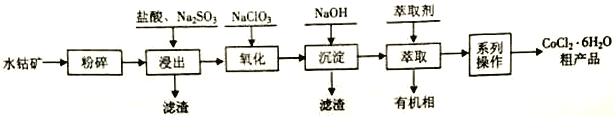
【题目】水钴矿的主要成分为Co2O3,还含SiO2及少量Al2O3、Fe2O3、 CuO、MnO2等。一种利用水钴矿制取CoCl2·6H2O 的工艺流程如下:
已知: ①CoCl2·6H2O受热易失去结晶水。
②25 ℃时,设定溶液中某金属离子初始浓度为0.1 molL-1,部分沉淀的参考数据如下表(“沉淀完全”指溶液中该离子浓度≤1.0×10-5molL-1):
沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.4 | 1.5 | 6.3 | 7.0 | 4.7 | 8.1 |
沉淀完全时pH | 4.7 | 2.8 | 8.3 | 9.0 | 6.7 | 10.1 |
回答下列问题
(1)计算25℃时Co(OH)2的Ksp =_______________。
(2)浸出工序中加入一定量的Na2SO3还原Co2O3、MnO2等,Co2O3发生反应的离子方程式为_______________________________。
(3)氧化工序要控制NaClO3用量,若不慎加入过量NaClO3,可能生成的有毒气体是______________;氧化工序主要反应的离子方程式为_______________________________。
(4)已知温度对铜、钴、铁的浸出率的影响如左下图,萃取剂A、B中pH对钴、锰离子萃取率的影响如右下图:

①浸出温度控制在50-60℃的原因是_________________________。
②应选择萃取剂_________________________(填“A”或“B”)。
(5)“系列操作”依次是____________、______________和过滤等;制得的CoCl2·6H2O需减压烘干的原因是_________________________。
【答案】 1.0×10-15 Co2O3+SO32-+4H+==2Co2++SO42-+2H2O Cl2 ClO3-+6Fe2++6H+==Cl-+6Fe3++3H2O 50~60℃时钴浸出率高,温度再升高时钴浸出率变化不大,且导致浸出液中含铁元素的杂质含量升高 B 蒸发浓缩 冷却结晶 降低烘干温度,防止CoCl2·6H2O分解
【解析】(1). 25℃,在含有Co2+0.1 molL-1的溶液中,当溶液的pH=7时,Co2+开始沉淀,则Co(OH)2的Ksp=c(Co2+)×c2(OH-)=0.1×(10-7)2=1.0×10-15,故答案为:1.0×10-15;
(2). 在浸出工序中加入一定量的盐酸和Na2SO3还原Co2O3,硫元素化合价升高生成SO42-,钴元素化合价降低生成Co2+,根据得失电子守恒和原子守恒,Co2O3发生反应的离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,故答案为:Co2O3+SO32-+4H+==2Co2++SO42-+2H2O;
(3). 氧化工序中加入NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,该反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,若不慎加入过量NaClO3,在酸性条件下,NaClO3与溶液中的Cl-会发生氧化还原反应生成有毒的Cl2,故答案为:Cl2;ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(4). ① .据图可知,50~60℃时钴的浸出率已经很高,且温度再升高时钴的浸出率变化不大,同时还会导致铁的浸出率增大,含铁元素的杂质含量升高,故答案为:50~60℃时钴浸出率高,温度再升高时钴浸出率变化不大,且导致浸出液中含铁元素的杂质含量升高;
②. 加入萃取剂的目的是除去Mn2+,据图可知,选择萃取剂B时,Mn2+的萃取率高而Co2+的萃取率低,所以应选择萃取剂B,故答案为:B;
(5). 从溶液中得到氯化钴晶体的系列操作步骤为:蒸发浓缩、冷却结晶和过滤,制得的CoCl2·6H2O采用减压烘干方法,可以降低烘干温度,防止CoCl2·6H2O晶体分解,故答案为:蒸发浓缩;冷却结晶;降低烘干温度,防止CoCl26H2O分解。