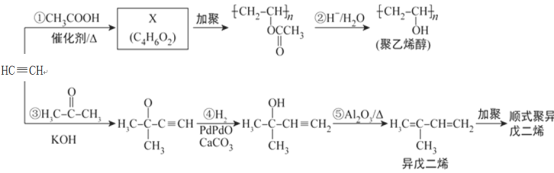
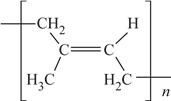
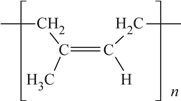
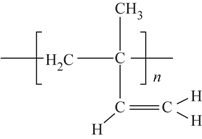
题目内容
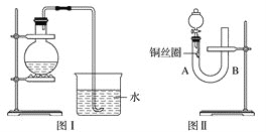
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,某研究小组以氢氧化钠固体、浓氨水、干冰等为原料制备氨基甲酸铵的实验装置如图所示,其主要反应的原理为2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<O。
NH2COONH4(s) △H<O。
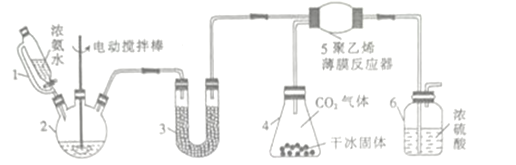
(1)仪器2的名称是________,仪器3中盛装的固体是_________,其作用是______________。
(2)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内浓硫酸中产生气泡,则应该______________(填“加快”“ 减慢”或“不改变”)产生氨气的速率。
(3)另一种制备氨基甲酸氨的反应装置(液体石蜡和CCl4均充当惰性介质)如图所示。
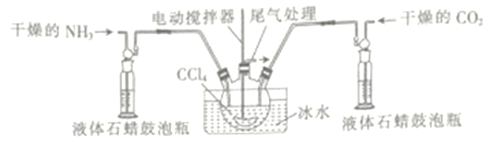
①液体石蜡鼓泡瓶的作用是_____________________ 。
②若无冰水,则氨基甲酸铁易分解生成尿素[CO(NH)2]2请写出氨基甲酸铵受热分解的化学方程式:_______________________。
③当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥,可采取的方法是_______________(填字母)。
A.蒸馏 B.真空微热烘干 C.高压加热烘干
(4)制得的氨基甲酸铵中可能含有碳酸氢铵、碳酸铵中的一种或两种杂质(不考虑氨基甲酸铵与水的反应)。
①设计方案进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解 | 得到无色溶液 |
步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,则证明固体中不含碳酸铵 |
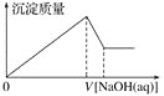
步骤3:向试管中继续加入___________ | _____________________________, 则证明固体中含有碳酸氢铵 |
②根据①的结论,取15.8g氨基甲酸氨样品,用足量氢氧化钡溶液充分处理后,过滤洗涤、干燥测得沉淀质量为1.97g。则样品中氨基甲酸铵的质量分数为_________________。
【答案】 三颈烧瓶 碱石灰 干燥氨气,防止仪器5中生成的氨基甲酸铵水解 加快 通过观察气泡,调节NH3与CO2的通入比例(或通过观察气泡,控制通入NH3与CO2的速率) H2NCOONH4![]() CO(NH2)2+H2O B 少量澄清石灰水 若溶液变浑浊 0.95(或95%)
CO(NH2)2+H2O B 少量澄清石灰水 若溶液变浑浊 0.95(或95%)
【解析】(1)仪器2为三颈烧瓶;由于氨基甲酸铵易水解,U型管内氢氧化钠干燥氨气,防止生成的氨基甲酸铵水解;故答案为:三颈烧瓶;干燥氨气,防止生成的氨基甲酸铵水解;
(2)若反应初期观察到装置内稀硫酸溶液中产生气泡,说明有二氧化碳排出,通入氨气的量不足,应该适当加快产生氨气的流速;故答案为:加快;
(3)①液体石蜡鼓泡瓶的作用是:通过观察气泡,调节NH3与CO2的通入比例(或通过观察气泡,控制通入NH3与CO2的速率) 。②氨基甲酸铁易分解生成尿素和水,方程式为: H2NCOONH4![]() CO(NH2)2+H2O。③因为氨基甲酸铵受热分解,所以不能用高温,所以选B。
CO(NH2)2+H2O。③因为氨基甲酸铵受热分解,所以不能用高温,所以选B。
(4)①检验氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种,实验操作为取少量固体样品于试管中,加入蒸馏水至固体溶解,向试管中加入过量的BaCl2溶液,若溶液不变浑浊,证明固体中不含碳酸铵,取试管中的上层清液,滴加澄清石灰水,若溶液变浑浊,证明固体中含有碳酸氢铵,故答案为:
实验步骤 | 预期现象和结论 |
步骤3:少量澄清石灰水 | 溶液变浑浊 |
②最终达到沉淀为碳酸钡,碳酸钡物质的量为![]() ,根据碳元素守恒可知碳酸氢铵的质量为0.01mol,则可得样品中氨基甲酸铵的质量为15.8g0.01mol×79g/mol=15.01g,故样品中氨基甲酸铵的质量为
,根据碳元素守恒可知碳酸氢铵的质量为0.01mol,则可得样品中氨基甲酸铵的质量为15.8g0.01mol×79g/mol=15.01g,故样品中氨基甲酸铵的质量为![]() ,故答案为:95%。
,故答案为:95%。

【题目】欲从含Br-的废液中提取溴单质,需经过一系列操作,实验装置及物质的性质如下:

Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3. 12 | 1.59 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
下列说法中正确的是
A. 可用装置甲氧化废液中的Br-
B. 装置乙中选用正十二烷而不用CCl4,是因为正十二烷的密度更小
C. 用装置丙进行蒸馏,先收集正十二烷再收集Br2
D. 用装置丁长期贮存液溴
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
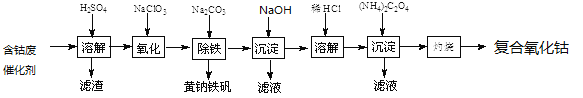
(1)用H2SO4溶解后过滤,得到的滤渣是_________(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____________________。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是___________________。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:_______________________。
(5)弱酸和弱碱的电离平衡常数的负对数可用pK表示,根据下表中数据判断(NH4)2C2O4溶液中各离子的浓度由大到小的顺序为__________________。
H2C2O4 | pKa1= l.25,pKa2=4.13 |
NH3·H2O | pKb=4.76 |
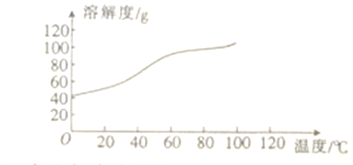
(6)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤其原因是_____________________。
(7)准确称取1.470gCoC2O4,在空气中充分灼烧得0.814g复合氧化钴,写出复合氧化钴的化学式:_________________________。