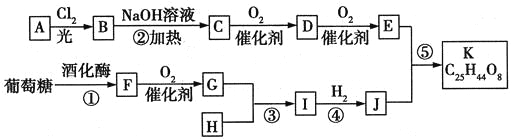
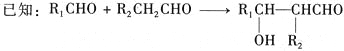题目内容
【题目】下列说法正确的是( )
A.常温下将pH均为a的氢氧化钠溶液和氢氧化钡溶液分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:b>c>a
B.常温下5.0×10-3mol·L-1KHA溶液的pH=3.75,该溶液中c(HA-)<c(A2-)
C.室温时,M(OH)2(s)![]() M2+(aq)+2OH-(aq)Ksp=a;c(M2+)=bmol·L-1时,溶液的pH等于14+
M2+(aq)+2OH-(aq)Ksp=a;c(M2+)=bmol·L-1时,溶液的pH等于14+![]() lg
lg![]()
D.Na2C2O4溶液:c(OH-)+2c(H2C2O4)=c(H+)+c(HC2O4-)
【答案】C
【解析】
A.将pH均为a的氢氧化钠溶液和氢氧化钡加水稀释100倍,碱性减弱,由于氢氧化钠和氢氧化钡均为强碱,故稀释后的pH相等,但要小于原来的pH,故a、b、c的大小关系是:a>b=c,A选项错误;
B.常温下5.0×10-3mol·L-1KHA溶液的pH=3.75,说明HA-在溶液中电离出部分H+和A2-,故c(HA-)>c(A2-),B选项错误;
C.Ksp=c(M2+)·c2(OH-)=a,则![]() ,常温下氢离子浓度为
,常温下氢离子浓度为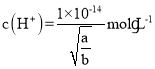 ,则该溶液的
,则该溶液的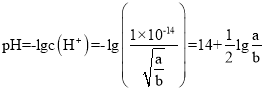 ,C选项正确;
,C选项正确;
D.Na2C2O4溶液中,根据质子守恒可得c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),D选项错误;
答案选C。

练习册系列答案
相关题目