题目内容
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
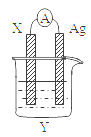
(1)电极X的材料是______;电解质溶液Y是________;
(2)银电极为电池的____极,发生的电极反应式为______; X电极上发生的电极反应为______;(填反应类型)
(3)外电路中的电子是从_______电极流向________电极。Ag+向_______ (填正极或负极)移动。
(4)当有1.6g铜溶解时,银棒增重_________________。
(5)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:H2+O2--2e-=H2O; B极:O2+4e-=2O2-。则A极是电池的______极;电子从该极____(填“流入”或“流出”),该电池的总反应为_______。
【答案】Cu AgNO3 正极 Ag++e-=Ag 氧化反应 X(或Cu) Ag 正极 5.4g 负 流出 2H2+O2 ===2H2O
【解析】
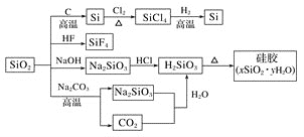
(1)在原电池的总反应方程式中,负极化合价升高,所以铜做负极,而负极的活泼性大于正极,因此,正极可以选择银或者碳棒。总反应式中银离子化合价降低,所以在电解质溶液中会含有银离子。因此电解质溶液可以选择硝酸银;故电极X的材料是Cu;电解质溶液Y是AgNO3;
(2)正极化合价降低,发生还原反应,银电极为电池的正极;电极反应式为 Ag++e-=Ag;X电极上铜失去电子,发生的电极反应为氧化反应;
(3)电子的流动方向是负极流向正极,所以应是X(或Cu)电极流向Ag电极;
(4)1.6g的铜相当于0.025mol的铜。即失去0.025![]() 2=0.05mol电子。而据得失电子总数相等可知,银离子应得到0.05mol的电子,由 Ag++e-=Ag可知会得到0.05mol的银,则银的质量为0.05mol
2=0.05mol电子。而据得失电子总数相等可知,银离子应得到0.05mol的电子,由 Ag++e-=Ag可知会得到0.05mol的银,则银的质量为0.05mol![]() 108g/mol=5.4 g;
108g/mol=5.4 g;
(5) 原电池中,失电子发生氧化反应的电极是负极,得电子发生还原反应的电极是正极,电子从负极沿导线流向正极,根据电极反应式知,通入氢气的电极失电子发生氧化反应,则A为负极,B为正极,电子从负极A电极沿导线流向正极B电极;则A极是电池的负极;电子从该极流出,该电池的总反应为2H2+O2 =2H2O。

【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D