题目内容
17.有以下四种物质:①22g二氧化碳 ②10g氢气 ③1.204×1024个氮气分子 ④4℃时18mL水.它们所含分子数最多的是②,所含原子数最多的是②,质量最大的是③(填序号)分析 根据n=$\frac{m}{M}$计算二氧化碳、氢气的物质的量,根据n=$\frac{N}{{N}_{A}}$计算氨气的物质的量,根据m=ρV计算水的质量,再根据n=$\frac{m}{M}$计算水的物质的量,
物质的量越大,含有的分子数目越多;
结合各物质分子含有的原子数目计算原子的物质的量,原子物质的量越大,含有原子数目越多;
根据m=cM计算氨气的质量,根据m=ρV计算水的质量,据此计算比较.
解答 解:①22g二氧化碳,其物质的量为:$\frac{22g}{44g/mol}$=0.5mol,
②10g氢气,其物质的量为:$\frac{10g}{2g/mol}$=5mol,
③1.204×1024个氮气分子,其物质的量为:$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=2mol,质量为2mol×28g/mol=56g,
④4℃时18mL水,其质量为18mL×1g/mL=18g,物质的量为:$\frac{18g}{18g/mol}$=1mol,
故所含分子数最多的是②10g氢气;
①22g二氧化碳,含有原子物质的量为:0.5mol×3=1.5mol,
②10g氢气,含有原子物质的量为:5mol×2=10mol,
③1.204×1024个氮气分子,含有原子物质的量为:2mol×2=4mol,
④4℃时18mL水,含有原子物质的量为:1mol×3=3mol,
故所含原子数最多的是 ②10g氢气,
由上述计算可知,质量最大是③1.204×1024个氮气分子,
故答案为:②;②;③.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与摩尔质量等物理量之间的关系为解答关键,试题充分考查了学生的分析、理解能力及化学计算能力.

已知:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
(1)写出A的电子式
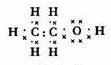 .
.(2)反应Ⅱ的化学方程式是2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是
 .
.(4)E是有香味的物质,在实验室用图2装置制取.
①反应IV的化学方程式是CH3COOH+HOCH2CH3
 CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.②该装置图中有一个明显的错误是导气管的出口伸入到饱和碳酸钠溶液液面以下.
(5)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中 试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.

| A. | 氨水的主要成分是NH3•H2O | |
| B. | 氨水可使酚酞指示剂变红 | |
| C. | 氨水中含三种分子和两种离子 | |
| D. | 氨水中溶质的质量分数越大,溶液密度越小 |
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$\stackrel{△}{→}$2CH3CHO+2H2O | D. | 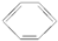 +Br$\stackrel{FeBr_{3}}{→}$ +Br$\stackrel{FeBr_{3}}{→}$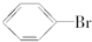 +HBr +HBr |
| A. | 单质铜与浓硝酸反应:Cu+2H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 氯气与氢氧化钠浓溶液反应:Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 向次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 氯化铵溶液与氢氧化钠溶液混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ |
| A. | M g | B. | $\frac{1}{M}$ g | C. | $\frac{M}{6.02×1{0}^{23}}$ g | D. | $\frac{6.02×1{0}^{23}}{M}$g |
| A. | 1 mol<n≤2 mol | B. | 1 mol<n≤4 mol | C. | 2 mol<n≤4 mol | D. | n>4 mol |