题目内容
12.下列反应中,属于加成反应的是( )| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$\stackrel{△}{→}$2CH3CHO+2H2O | D. | 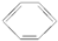 +Br$\stackrel{FeBr_{3}}{→}$ +Br$\stackrel{FeBr_{3}}{→}$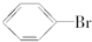 +HBr +HBr |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应,根据定义分析解答.
解答 解:A.甲烷和氯气混合光照后,甲烷中的氢原子被氯原子所代替生成氯代物,属于取代反应,故A错误;
B.乙烯中的双键断裂,每个碳原子上分别结合结合一个氯原子、氢原子生成氯乙烷,属于加成反应,故B正确;
C.CH3CH2OH在铜催化下反应生成乙醛,属于氧化反应,故C错误;
D.苯环上的氢原子被溴原子取代生成溴苯,属于取代反应,故D错误;
故选:B.
点评 本题考查有机物的性质,注意取代反应与其它反应类型的区别,题目较为简单.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
7.下列仪器的刻度位置不正确的是( )
| A. | 100 mL量筒的0刻度在最下方 | |
| B. | 天平上游码标尺最左方的刻度为0 | |
| C. | 一般温度计的0刻度在中间位置 | |
| D. | 容量瓶的刻度无数字,只是瓶颈上的一个水平环 |
4.实验测得一氧化碳与氧气混合气体的密度是氢气的14.5倍,则其中氧气的质量分数为( )
| A. | 25.0% | B. | 27.6% | C. | 72.4% | D. | 75.0% |
1.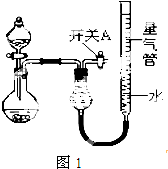 某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)实验过程中,使用分液漏斗滴加液体的操作是打开分液漏斗上口塞子,旋开下面的开关,慢慢滴加;
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”),原因是NO会与装置中空气反应;生成NO2溶于水
(3)实验Ⅱ中量气管中的液体最好是C(填字母编号,下同)
A.浓NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
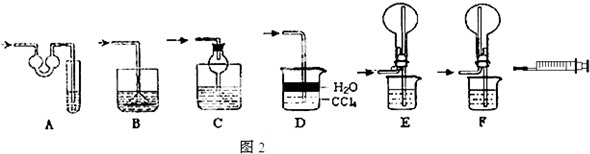
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,不能防止倒吸的是图2中的BE.
(4)写出实验Ⅲ中涉及的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑;
(5)实验Ⅲ获得如表数据(气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
根据表中数据,可计算出镁铝合金中铝的质量分数为27%.
 某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”),原因是NO会与装置中空气反应;生成NO2溶于水
(3)实验Ⅱ中量气管中的液体最好是C(填字母编号,下同)
A.浓NaOH溶液 B.氨水 C.煤油 D.氯化铵溶液
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,不能防止倒吸的是图2中的BE.

(4)写出实验Ⅲ中涉及的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑;
(5)实验Ⅲ获得如表数据(气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
