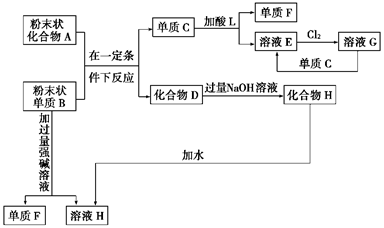
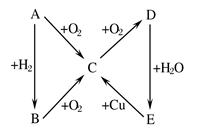
题目内容
利用元素周期表,我们可以认识更多元素的性质。
(1)根据元素周期表来比较Mg和Cs的金属性,要通过另一种元素作中介或桥梁进行比较, 这种元素是 。(填元素符号)
(2)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。
①已知2Al+2NaOH+2H2O=2NaAlO2+3H2↑,写出Be与NaOH溶液反应的离子方程式) 。
②鉴别Be(OH)2和Mg(OH)2可选用的试剂为 。
(3)科学家证实,BeCl2属于共价化合物,设计一个简单实验证明这一点,你想到的可行的方法是 。
(4)元素周期表中某一元素具有如下性质:①该元素单质常被用作半导体材料。②其单质与稀盐酸不反应,与氢氧化钠溶液反应可以放出氢气。③其最高价氧化物既可以溶于浓盐酸,也可以溶于氢氧化钠溶液。④其最高价氧化物对应的水化物既可以和酸反应,也可以和碱反应。在与盐酸反应时,1mol这种最高价氧化物对应的水化物最多消耗4mol/ L 的盐酸1L。 请你写出这种元素在周期表中的位置: 。
(1)根据元素周期表来比较Mg和Cs的金属性,要通过另一种元素作中介或桥梁进行比较, 这种元素是 。(填元素符号)
(2)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。
①已知2Al+2NaOH+2H2O=2NaAlO2+3H2↑,写出Be与NaOH溶液反应的离子方程式) 。
②鉴别Be(OH)2和Mg(OH)2可选用的试剂为 。
(3)科学家证实,BeCl2属于共价化合物,设计一个简单实验证明这一点,你想到的可行的方法是 。
(4)元素周期表中某一元素具有如下性质:①该元素单质常被用作半导体材料。②其单质与稀盐酸不反应,与氢氧化钠溶液反应可以放出氢气。③其最高价氧化物既可以溶于浓盐酸,也可以溶于氢氧化钠溶液。④其最高价氧化物对应的水化物既可以和酸反应,也可以和碱反应。在与盐酸反应时,1mol这种最高价氧化物对应的水化物最多消耗4mol/ L 的盐酸1L。 请你写出这种元素在周期表中的位置: 。
(9分)(1)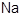 或 Ba (1分)
或 Ba (1分)
(2)①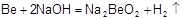 (2分) ②
(2分) ②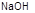 溶液 (1分)
溶液 (1分)
(3)融化状态下是否能够导电,导电为离子化合物,否则为共价化合物(2分)
(4)第4周期 第ⅣA族 (3分) 注:答第3周期为0分
方程式中反应物或生成物出错(如NaBeO2)为0分,配平错为0分,条件或气体符号未标扣1分。
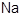 或 Ba (1分)
或 Ba (1分) (2)①
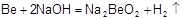 (2分) ②
(2分) ②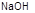 溶液 (1分)
溶液 (1分) (3)融化状态下是否能够导电,导电为离子化合物,否则为共价化合物(2分)
(4)第4周期 第ⅣA族 (3分) 注:答第3周期为0分
方程式中反应物或生成物出错(如NaBeO2)为0分,配平错为0分,条件或气体符号未标扣1分。
试题分析:(1)根据元素周期表的结构可知,要比较Mg和Cs的金属性,需要通过另一种元素作中介或桥梁进行比较,该元素是
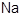 或Ba。
或Ba。(2)①金属Be单质及其化合物的性质与铝单质及其化合物的性质相似,则Be与NaOH溶液反应的离子方程式为
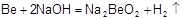 。
。②由于氢氧化铝和Be(OH)2的化学性质相似,都是两性氢氧化物,所以鉴别Be(OH)2和Mg(OH)2可选用的试剂为氢氧化钠溶液。
(3)含有离子键的化合物是离子化合物,而离子键再熔化是可以电离出离子,既熔融是可以导电。但共价键再熔融是不变,不能导电,据此可以判断化合物是离子化合物还是共价化合物。
(4)根据①②可知该元素可能是Si或Ge。但依据③④可知,该元素不可能是是Si,应该是Ge,其余第四周期第ⅣA族。
点评:该题是中等难度的试题,试题综合性强,注重对学生基础知识的巩固和检查,有利于培养相似的逻辑推理能力和发散思维能力,通过学生分析问题、灵活运用基础知识解决实际问题的能力,也有助于培养学生的知识迁移能力和自学能力。

练习册系列答案
相关题目