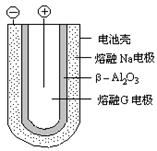
题目内容
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良
导体。下列判断不正确的是

A.e、f单质晶体熔化时克服的是共价键
B.d单质对应元素原子的电子排布式:1s22s22p63s23p2
C.b元素形成的最高价含氧酸易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子中含2个σ键,2个π键
导体。下列判断不正确的是

A.e、f单质晶体熔化时克服的是共价键
B.d单质对应元素原子的电子排布式:1s22s22p63s23p2
C.b元素形成的最高价含氧酸易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子中含2个σ键,2个π键
B
试题分析:B项:d为Cu,是29号元素,原子的电子排布式为1s22s22p63s23p63d104s1,故错。故选B。
点评:考查电子排布、化学键、分子结构与性质,难度中等,旨在考查对知识的综合运用和掌握。

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
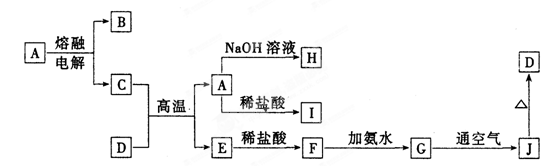 请回答
请回答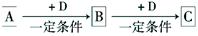
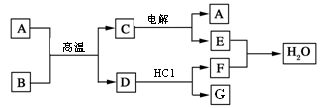
 NaCl +D
NaCl +D