题目内容
【题目】下列物质有关用途与性质的对应关系错误的是( )
物质 | 用途 | 性质 | |
A | 小苏打 | 用于焙制糕点 | 小苏打能与碱反应 |
B | 金属钠 | 用于冶炼钛、锆等金属 | 金属钠有强还原性 |
C | 二氧化硫 | 常用于漂白秸秆、织物 | SO2能跟其中的有色物质结合 |
D | 铁粉 | 用于食品中的脱氧剂 | Fe具有还原性 |
A.AB.BC.CD.D
【答案】A
【解析】
A.小苏打用来焙制糕点是因为其受热易分解,产生的二氧化碳使糕点疏松多孔,A错误;
B.金属钠具有很强的还原性,因此可用来冶炼钛、锆等金属,B正确;
C.二氧化硫可以与一些有色物质化合生成无色物质,常用于漂白秸秆、织物,C正确;
D.铁粉具有较强的还原性,可以和空气中的氧气反应,可用于食品中的脱氧剂,D正确;
答案选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | - |
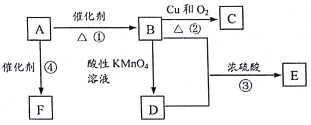
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理? ______ (填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,反应的离子方程式为 ______ .
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 ______ (填序号).
A、浓硫酸B、稀硫酸 C、稀硝酸D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入6molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
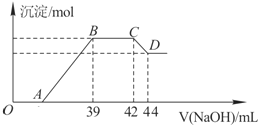
(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式: ______
(2)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ______ ;
(3)熔融物中铝元素的物质的量为 ______ mol.
(4)B点对应的沉淀的物质的量为 ______ mol,A点对应的氢氧化钠溶液的体积为 ______ mL.
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________,该能层为次外层时最多可以容纳的电子数为_________。元素Ca和S相比,第一电离能较大的是______(填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______(填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______,但H2O分子键角大于H2S分子,原因是________________。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________。
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
氧化物晶体 | MgO | MnO | CaO |
a/nm | 0.421 | 0.444 | 0.480 |
硫化物晶体 | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
由表可知:r(S2-)____r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是__________,r(S2- )为_____nm,r(Ca2+)为_____nm。