题目内容
【题目】工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为 _;
②硫酸钠和焦炭、石灰石反应的化学方程式为_ (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
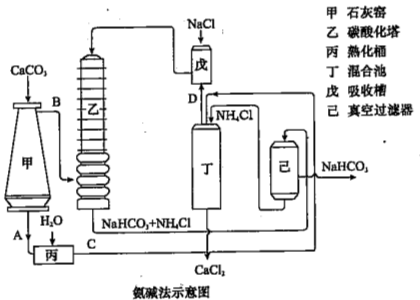
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为 ;
(3)联合制碱法对氨碱法的改进,其优点是 ;
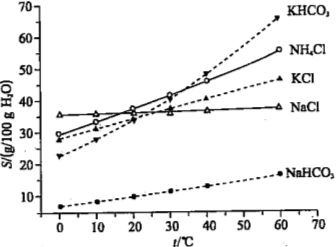
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?
【答案】
(1)①NaCl+H2SO4(浓)=NaHSO4+HCl↑或2NaCl+H2SO4(浓) ![]() Na2SO4+2HCl↑;
Na2SO4+2HCl↑;
②Na2SO4+ 2C+CaCO3 ![]() CaS+Na2CO3+2CO2↑;
CaS+Na2CO3+2CO2↑;
(2)①Ca(OH)2;NH3;②NH3 + CO2 +NaCl +H2O = NaHCO3↓+ NH4Cl ;
(3)提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2.;
(4)不可行;因为KHCO3的溶解度较大,且在常温下与KCl溶解度相差小,在铵盐水碳酸化时无法大量析出。
【解析】
试题分析:(1)①利用高沸点酸制备挥发性酸,且HCl极易溶于水,故利用直接使用98%浓硫酸和氯化钠制取氯化氢,反应为:NaCl+H2SO4(浓)![]() NaHSO4+HCl↑或2NaCl+H2SO4(浓)
NaHSO4+HCl↑或2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑,故答案为:NaCl+H2SO4(浓)
Na2SO4+2HCl↑,故答案为:NaCl+H2SO4(浓)![]() NaHSO4+HCl↑或2NaCl+H2SO4(浓)
NaHSO4+HCl↑或2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑;
Na2SO4+2HCl↑;
②由题目信息可知,硫酸钠与石灰石、焦炭反应生成CaS、Na2CO3,根据元素守恒可知,还原C的氧化物CO或CO2生成,故反应方程式为:Na2SO4+4C+CaCO3![]() CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3
CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3 ![]() CaS+Na2CO3+2CO2,故答案为:Na2SO4+4C+CaCO3
CaS+Na2CO3+2CO2,故答案为:Na2SO4+4C+CaCO3![]() CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3
CaS+Na2CO3+4CO或Na2SO4+2C+CaCO3 ![]() CaS+Na2CO3+2CO2;
CaS+Na2CO3+2CO2;
(2)①碳酸钙加热分解生成CaO与CO2,故A为CaO,B为CO2,CaO在熟化桶内与水反应生成氢氧化钙,故C为Ca(OH)2;氢氧化钙与氯化铵在混合池内反应生成氨气与氯化钙,故D为NH3,故答案为:Ca(OH)2;NH3;
②氨气与氯化钠溶液混合后,在乙中与二氧化碳发生反应,生成NaHCO3、NH4Cl,反应方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl,故答案为:NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;
(3)该方法能提高原料的利用率,减少废渣的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH4Cl 可做氮肥;可与合成氨厂联合,可利用合成氨的产物CO2,故答案为:提高食盐利用率、副产物氯化铵可用作化肥、可利用合成氨的产物CO2;
(4)由溶解曲线图可知KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,由图象可知,降温结晶时会析出较多的KCl,无法大量析出碳酸氢钾;故答案为:不可行; 因为KHCO3的溶解度较大,且在常温下与KCl溶解度相差小,在铵盐水碳酸化时无法大量析出。




