题目内容
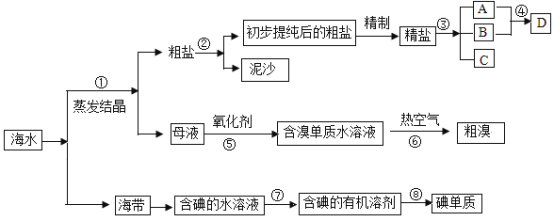
【题目】以下是某工厂的生产流程:
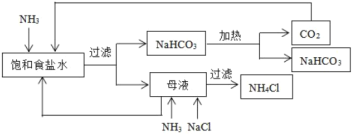
下列分析正确的是( )
A.母液中只含有:NH3和CO2B.母液中只含有:NH4+和Cl-
C.向母液中通NH3、加NaCl时加热D.该工厂的产品是纯碱和NH4Cl
【答案】D
【解析】
氨化的饱和食盐水中通入二氧化碳发生反应生成碳酸氢钠晶体和氯化铵溶液,过滤得到碳酸氢钠加热分解生成碳酸钠和二氧化碳,二氧化碳循环使用,母液中加入氯化钠通入氨气过滤得到氯化铵晶体,剩余氯化钠循环使用,据此分析判断。
A. 循环使用的物质为NaCl和CO2,故A错误;
B. 碳酸氢钠溶于水,母液中含有少量的碳酸氢钠,故B错误;
C. 向母液中通NH3、加NaCl时,不需要加热,加热促进氯化铵分解,故C错误;
D. 流程分析可知该工厂的产品是纯碱和NH4Cl,故D正确;
答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
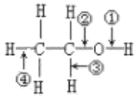
【题目】表格中如图是乙醇分子的化学键断键位置的示意图。下列对乙醇发生反应时的反应条件、断键方式及主要有机产物的叙述中错误的是( )
选项 | 反应条件 | 断键位置 | 主要有机产物 | 乙醇的分子结构 |
A.与钠反应 | 常温 | ① | CH3CH2ONa |
|
B.催化氧化 | Cu或Ag | ②③ | CH3COOH | |
C.消除反应 | 浓硫酸,170℃ | ③④ | CH2=CH2 | |
D.与HBr反应 | △ | ② | CH3CH2ONa |
A.AB.BC.CD.D