题目内容
不同金属离子在溶液中完全沉淀时,溶液的pH不同。

氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。
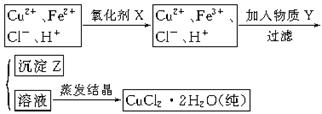
(1)下列氧化剂中适合作氧化剂X的是 (填序号);
(2)物质Y的化学式是 、 ;(任写两种)
(3)写出从(2)题任选一个物质Y参与反应生成沉淀Z离子方程式: 。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(5)氢氧化铜常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。

氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。

(1)下列氧化剂中适合作氧化剂X的是 (填序号);
| A.NaClO | B.H2O2 | C.KMnO4 | D.Cl2 |
(3)写出从(2)题任选一个物质Y参与反应生成沉淀Z离子方程式: 。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(5)氢氧化铜常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
(1)B、D;(2)CuO或Cu(OH)2或CuCO3;(3)2Fe3++6H2O+3CuO=2Fe(OH)3↓+3Cu2+;
(4)不能,将CuCl2溶液放在无水氯化氢气流中加热。(5)5
(4)不能,将CuCl2溶液放在无水氯化氢气流中加热。(5)5
试题分析:(1)在氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体应该把杂质除去。但是Fe2+形成沉淀的pH与Cu2+形成沉淀的pH很相近,不容易除去。若加入氧化剂把Fe2+氧化为Fe3+就很容易除去了。在选择氧化剂时不要引入新的杂质离子。所以应该选择绿色氧化剂B.H2O2或D.Cl2.(2)加入物质Y用以调节溶液的pH值,而且不引入杂质。可以加入CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3等。(3)假设以CuO为例,反应的两种方程式为2Fe3++6H2O+3CuO=2Fe(OH)3↓+3Cu2+;(4) CuCl2是容易挥发的强酸与弱碱发生反应得到的盐,若直接加热蒸发溶液,水解产生的HCl会随着水分的蒸发而溢出,最后得到的为Cu(OH)2,所以最后不能直接蒸发结晶得到CuCl2·2H2O晶体。为防止其水解导致变质,应该将溶液放在无水氯化氢气流中加热就可以CuCl2·2H2O晶体。(5)由于氢氧化铜常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。若c(Cu2+)=0.02mol/L,则
 c(H+)=Kw÷c(OH-)=10-14÷10-9=10-5;所以pH=5。
c(H+)=Kw÷c(OH-)=10-14÷10-9=10-5;所以pH=5。
练习册系列答案
相关题目
 Fe2++SO42-
Fe2++SO42-
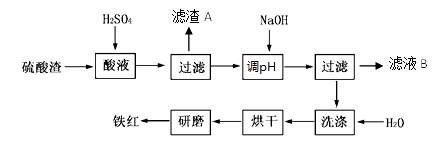
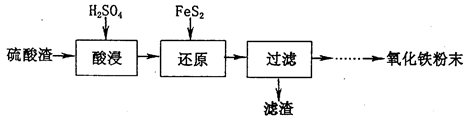
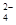 ,该反应的离子方程式为____________.
,该反应的离子方程式为____________.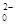
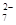 +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O