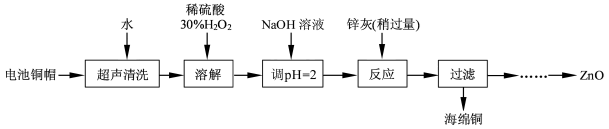
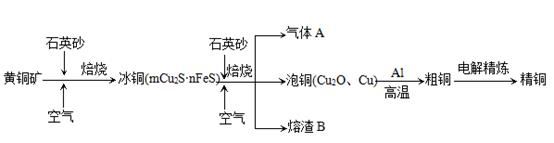
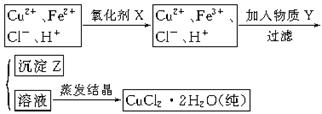
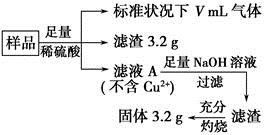
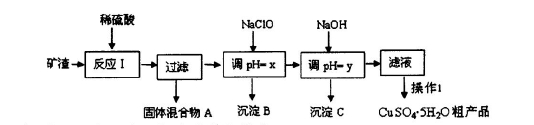
题目内容
【化学一选修2:化学与技术】(15分)
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
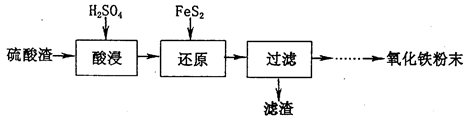
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO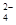 ,该反应的离子方程式为____________.
,该反应的离子方程式为____________.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl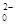
Sn2++4Cl-+2HgCl2="==" SnCl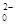 +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ Cr2O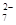 +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
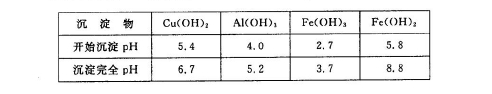
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________________________________;b.沉淀:_____________________________;
c.分离,洗涤;d.烘干,研磨。
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO
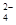 ,该反应的离子方程式为____________.
,该反应的离子方程式为____________.(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl
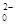
Sn2++4Cl-+2HgCl2="==" SnCl
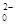 +Hg2Cl2↓
+Hg2Cl2↓6Fe2++ Cr2O
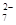 +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 12.4 | 9.8 |
a.氧化:________________________________;b.沉淀:_____________________________;
c.分离,洗涤;d.烘干,研磨。
(1)抑制Fe3+的水解(2分)
(2)14Fe3++FeS2+8H2O ===15Fe2++2SO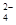 +16H+(2分)
+16H+(2分)
(3)①偏低,②若不加HgCl2,溶液中含有Sn2+,也可以被酸性高锰酸钾氧化,消耗的酸性高锰酸钾氧化偏大,则测定的Fe3+量偏高。(2分)
(4)①KSCN(2分);4Fe2++O2+4H+ ===4Fe3++H2O (2分);
②a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌(2分);
b.滴加NaOH溶液,调节溶液的pH为3.2~3.8(2分)
(2)14Fe3++FeS2+8H2O ===15Fe2++2SO
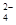 +16H+(2分)
+16H+(2分)(3)①偏低,②若不加HgCl2,溶液中含有Sn2+,也可以被酸性高锰酸钾氧化,消耗的酸性高锰酸钾氧化偏大,则测定的Fe3+量偏高。(2分)
(4)①KSCN(2分);4Fe2++O2+4H+ ===4Fe3++H2O (2分);
②a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌(2分);
b.滴加NaOH溶液,调节溶液的pH为3.2~3.8(2分)
试题分析:(1) 酸浸”中硫酸要适当过量,抑制Fe3+的水解;
(2)由信息Fe3+转化为Fe2+,同时FeS2被氧化为SO
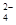 ,在利用氧化还原反应配平方程式:14Fe3++FeS2+8H2O ===15Fe2++2SO
,在利用氧化还原反应配平方程式:14Fe3++FeS2+8H2O ===15Fe2++2SO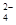 +16H+;
+16H+;(3)①若SnCl2不足量,Fe3+没有完全还原为Fe2+,则测定的Fe3+量偏低,②若不加HgCl2,溶液中含有Sn2+,也可以被酸性高锰酸钾氧化,消耗的酸性高锰酸钾氧化偏大,则测定的Fe3+量偏高。
(4)①检验滤液中含有Fe3+是KSCN溶液;Fe2+的氧化反应是:4Fe2++O2+4H+ ===4Fe3++H2O;
②a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌;b.滴加NaOH溶液,调节溶液的pH为3.2~3.8,使Fe3++完全沉淀。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目