题目内容
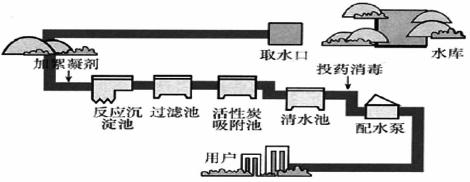
生产自来水的流程如图所示:回答下列问题。
(1)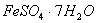 是常用的絮凝剂,它在水中最终生成__________沉淀(填化学式)。
是常用的絮凝剂,它在水中最终生成__________沉淀(填化学式)。
(2)天然水中含有较多的钙、镁离子,称为硬水。生活中常用__________方法来降低水的硬度。
(3)过滤池利用了实验室过滤原理,在实验室过滤操作所用到的玻璃仪器是__________。
(4)“投药消毒”中的“药”指漂白粉,请写出制取漂白粉的化学方程式__________。
(5)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。
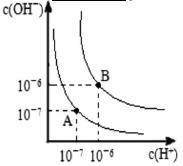
①100℃时1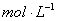 的NaOH溶液中,由水电离出的c(H+)=________
的NaOH溶液中,由水电离出的c(H+)=________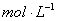 ,Kw(25℃)__________Kw(100℃)(填“>”“<”或“=”)。
,Kw(25℃)__________Kw(100℃)(填“>”“<”或“=”)。
②25℃时,向含100ml水的烧杯中逐渐加入一定量的冰醋酸,下列叙述正确的有__________(填字母)。
A. 溶液中一直存在: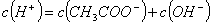
B. 加入过程中,水的电离程度逐渐减小,醋酸的电离程度逐渐增大
C. 加入过程中,溶液中所有离子浓度逐渐增大
D. 加完冰醋酸后,若升高烧杯温度,溶液pH值降低
E. 用已知浓度的NaOH溶液滴定烧杯中的醋酸溶液,测定其浓度,最好选用甲基橙作指示剂
(1)Fe(OH)3 (2分)
(2)煮沸(2分)
(3)漏斗、烧杯、玻璃棒 (3分)
(4)Cl2 + 2Ca(OH)2 =CaCl2 + Ca(ClO)2 +2H2O (3分)
(5)①1×10-12 < (2分) ②AD (2分)

I.在温度为T时,向2.0 L恒容密闭容器中充入1.0 mol A和1.0 mol B,发生反应A(g)+B(g)  C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
回答下列问题:
(1)反应前5 s的平均反应速率v(A) =____________
(2)温度为T时,该反应的化学平衡常数=
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH (填 “>0” 或 “<0”)
(4)相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C,反应达到平衡前,反应速率v正 v逆(填“>” 或 “<”)
(5)下列措施能增大反应速率,且平衡往正反应方向移动是 。
a.及时分离出A气体 b.适当升高温度
c.增大B的浓度 d.选择高效催化剂
II.NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是
右图所示的电解池I和II中,a、b、c和d均为石墨电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是( )
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |

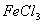 溶液与
溶液与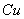 的反应:
的反应: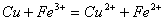
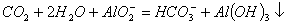
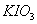 氧化酸性溶液中的
氧化酸性溶液中的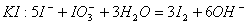
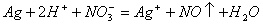

 溶液变为血红色,由此推知A的化学式为__________。
溶液变为血红色,由此推知A的化学式为__________。 _______________________。
_______________________。 E__________、F__________。
E__________、F__________。 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是