��Ŀ����
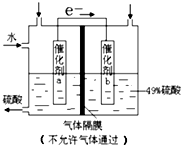
����Ŀ�����ͼ��ѡ�ñ�Ҫ��װ�ý��е�ⱥ��ʳ��ˮ��ʵ�飬Ҫ��ⶨ���������������������25mL���������������������ԣ� 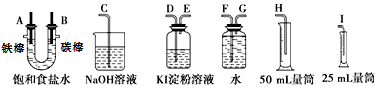
��1��A�������ĵ缫��Ӧʽ�� �� B�������ĵ缫��Ӧʽ�� ��
��2�������������ʵ��װ��ʱ�����ӿڵ���ȷ����˳��Ϊ��
A��������B������ ��
��3����ʵ���У�ʢ��KI������Һ�������з�����Ӧ�����ӷ���ʽΪ
��4����֪����ʳ��ˮ50mL������NaCl�����Һ�����Һ����仯����ijʱ�̲��H2���Ϊ16.8mL����״��������ʱ��ҺpHԼΪ �� ��lg2=0.3��lg3=0.5��lg5=0.7��
��5����֪����ȼ�ϵ�ز��ò�Ϊ�缫���ϣ����缫�Ϸֱ�ͨ��CH4��O2 �� �����ΪKOH��Һ��ij�о�С�齫����ȼ�ϵ����Ϊ��Դ��������������ʳ��ˮ���ʵ�飮������ͨ����Ϊ1L����״�������ҷ�Ӧ��ȫ����������ͨ�����صĵ���Ϊ����֪NA=6.02��1023mol��1 �� ���ӵ��Ϊ1.60��10��19C����ʽ��ʾ���ɣ���
���𰸡�
��1��2H++2e��=H2����2Cl����2e��=Cl2��
��2��G��F��H��D��E��C
��3��Cl2+2I��=I2+2Cl��
��4��12.5
��5��![]() ��8��6.02��1023��1.60��10��19C
��8��6.02��1023��1.60��10��19C
���������⣺��1��A��������B���������ö��Ե缫��ⱥ��ʳ��ˮʱ�������������ӷŵ����������������������ӷŵ��������������������������缫��Ӧʽ�ֱ�Ϊ2H++2e��=H2����2Cl����2e��=Cl2�������Դ��ǣ�2H++2e��=H2����2Cl����2e��=Cl2������2����������ǿ�����ԣ����������������ɵ⣬����������Һ����ɫ�����Կ����õ���KI��Һ���������������ԣ������ж������ſգ�Ӧ���ü�Һ����β����������������ˮ�����Բ�����ˮ���ռ�������������������˳����A��G��F��H��B��D��E��C��
���Դ��ǣ�G��F��H��D��E��C����3�������͵����ӷ����û���Ӧ���ɵ�������ӣ����ӷ���ʽΪCl2+2I��=I2+2Cl�� �� ���Դ��ǣ�Cl2+2I��=I2+2Cl������4�����ⱥ��ʳ��ˮ�ķ���ʽ��2NaCl+2H2O ![]() 2NaOH+H2��+Cl2������������H2�����Ϊ16.8mL��
2NaOH+H2��+Cl2������������H2�����Ϊ16.8mL�� ![]() =0.00075molʱ�������������Ƶ����ʵ���Ϊ0.0015mol��������Һ��NaOH�����ʵ���Ũ��=
=0.00075molʱ�������������Ƶ����ʵ���Ϊ0.0015mol��������Һ��NaOH�����ʵ���Ũ��= ![]() �T0.03mol/L�����������ӵ�Ũ��Ϊ
�T0.03mol/L�����������ӵ�Ũ��Ϊ ![]() =
= ![]() ��10��12mol/L������pH=12.5�����Դ��ǣ�12.5����5�����ݵ�ʧ�����غ㣬�ɵã�1 mol CH4��8 mol e�� �� ���ؼ���ͨ����Ϊ1 L����״���������Ե���ͨ���ĵ���Ϊ
��10��12mol/L������pH=12.5�����Դ��ǣ�12.5����5�����ݵ�ʧ�����غ㣬�ɵã�1 mol CH4��8 mol e�� �� ���ؼ���ͨ����Ϊ1 L����״���������Ե���ͨ���ĵ���Ϊ ![]() ��8��6.02��1023��1.60��10��19C�����Դ��ǣ�
��8��6.02��1023��1.60��10��19C�����Դ��ǣ� ![]() ��8��6.02��1023��1.60��10��19C��
��8��6.02��1023��1.60��10��19C��

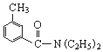
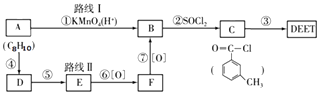
 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�