题目内容
【题目】图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( ) 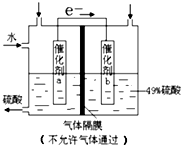
A.该装置将化学能转化为电能,电流方向为b→a
B.催化剂b表面O2发生还原反应,其附近酸性增强
C.催化剂a表面的反应:SO2+2H2O﹣2e﹣=SO ![]() +4H+
+4H+
D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15
【答案】B
【解析】解:A.该装置没有外加电源,是一个原电池,把化学能转化为电能,电流方向与电子流向相反,所以电流方向为b→a,故A正确;B.由图示可看出,电子由a表面转移到b表面,因此a表面发生氧化反应,由题意SO2转化为H2SO4发生氧化反应,因此催化剂a表面SO2发生氧化反应,催化剂b表面O2发生还原反应生成H2O,消耗H+ , 其附近酸性减弱,故B错误;
C.催化剂a表面是SO2失去电子生成硫酸,电极方程式为:SO2+2H2O﹣2e﹣=SO42﹣+4H+ , 故C正确;
D.催化剂a处的反应为:SO2+2H2O﹣2e﹣=SO ![]() +4H+ ,
+4H+ ,
催化剂b处的反应为: ![]() O2+2H++2e﹣=H2O
O2+2H++2e﹣=H2O
总方程为:SO2+H2O+ ![]() O2=H2SO4
O2=H2SO4
设加入的SO2为xg,H2O为yg.
则生成硫酸的质量为: ![]()
水的质量变化为:y﹣ ![]()
根据二者的比值为49%,可以求得 ![]() =
= ![]() ,故D正确;
,故D正确;
故选B.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目