题目内容
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。
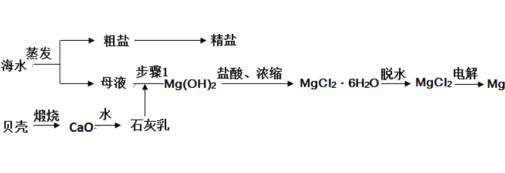
I.(1)上述过程中没有涉及到的四种基本反应类型是_____;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤 1 中分离操作的名称是_____;
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:a.盐酸;b.BaCl2溶液;c.NaOH 溶液;d.Na2CO3 溶液。加入试剂的顺序是_____;
II.实验室利用精盐配制 240mL 2.0mol/LNaCl 溶液。
(1)除烧杯和玻璃棒外,还需要的玻璃仪器有_____;
(2)用托盘天平称取固体 NaCl_____g;
(3)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦ 摇匀 ⑧装瓶。操作中还缺少一个重要步骤是_____;
(4)下列错误操作可使所配制氯化钠溶液浓度偏低的是_____。
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
e.称量固体的砝码已生锈
【答案】c 过滤 bdca或cbda或bcda 250ml容量瓶、胶头滴管 29.3 洗涤(烧杯和玻璃棒) bd
【解析】
I.海水蒸发得到粗盐,提纯得到精盐,贝壳煅烧生成的氧化钙,溶于水生成氢氧化钙石灰乳,母液中加入石灰乳沉淀镁离子,过滤得到沉淀加入盐酸得到氯化镁溶液,溶液浓缩蒸发、冷却结晶、过滤洗涤得到氯化镁晶体,在氯化氢气流中脱水得到氯化镁,电极熔融氯化镁得到金属镁。
(1)分析可知过程中涉及到分解、化合、复分解反应;
(2)步骤1中分离操作是分离固体和溶液的操作;
(3)溶液中的杂质离子为钙离子、镁离子、和硫酸根离子,根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
II. (1)根据配制一定物质的量浓度溶液的步骤来分析;
(2)由于实验室无240mL容量瓶,故应选用250mL容量瓶,配制出250mL溶液,据此计算所需的氯化钠的质量;
(3)根据一定物质的量浓度溶液的配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析;
(4)根据物质的量浓度c=![]() 结合配制操作来分析。
结合配制操作来分析。
I.(1)贝壳煅烧生成的氧化钙,为分解反应,溶于水生成氢氧化钙(石灰乳)为化合反应,加入的氢氧化钙和镁离子反应生成氢氧化镁沉淀的反应为复分解反应,过程中不涉及置换反应,故合理选项是c;
(2)步骤1中分离操作是分离固体和溶液的操作,操作的名称是过滤;
(3)首先要把粗盐溶于水形成溶液,然后Mg2+用OH-沉淀,加入过量的氢氧化钠可以将Mg2+沉淀,SO42-用Ba2+沉淀,加入过量的氯化钡可以将SO42-沉淀,至于先除Mg2+,还是先除SO42-都可以,Ca2+用CO32-沉淀,除Ca2+加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的CO32-和OH-,涉及离子方程式有Ba2++SO42-=BaSO4↓、Mg2++2OH-=Mg(OH)2↓、Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓、H++OH-=H2O、2H++CO32-=H2O+CO2↑。所以加入的试剂有:NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸或BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸,或BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸;故答案为:cbda或bcda或bdca;
II. (1)根据配制一定物质的量浓度溶液的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的玻璃仪器有烧杯、玻璃棒、250mL容量瓶和胶头滴管,故还缺少250mL容量瓶和胶头滴管;
(2)由于实验室无240mL容量瓶,故应选用250mL容量瓶,配制出250mL溶液,故所需的氯化钠的质量m=nM=cVM=2mol/L×0.25L×58.5g/mol=29.3g,答案为:29.3g;
(3)根据一定物质的量浓度溶液的配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知,还缺少的步骤是洗涤(烧杯和玻璃棒),
(4)a.容量瓶洗净后残留了部分的水,对浓度无影响,a错误;
b.转移时溶液溅到容量瓶外面,会导致溶质损失,则浓度偏小,b正确;
c.定容时俯视容量瓶的刻度线,会导致溶液体积偏小,则浓度偏大,c错误;
d.摇匀后见液面下降是正常的,再加水至刻度线会导致浓度偏小,d正确;
e.称量固体的砝码已生锈,说明砝码质量质量增加,则以此砝码为标准称量质量也增大,用该物质配制溶液,溶液的浓度偏大,e错误;
故合理选项是bd。

 阅读快车系列答案
阅读快车系列答案【题目】(双选)下列关于乙炔制取的说法不正确的是( )
A.为了加快反应速率可用饱和食盐水代替水反应
B.此反应是放热反应
C.为了除去杂质气体,除了用硫化铜外还可用氢氧化钠溶液
D.反应中不需加碎瓷片作沸石
【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25