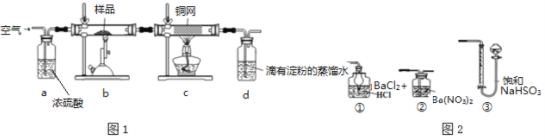
��Ŀ����
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���������������Ϣ���ɣ��±����������ֶ����ڵ�ԭ�Ӱ뾶����Ҫ���ϼۣ���֪���ԭ�Ӱ뾶Ϊ0.089nm��
Ԫ�ش��� | A | B | C | D | E |
ԭ�Ӱ뾶/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
��Ҫ���ϼ� | +2 | +3 | +6����2 | ��1 | ��2 |
��1��A��E��Ԫ����ɵĻ�����ĵ���ʽ ��
��2��B������������ˮ������C������������ˮ���ﷴӦ�����ӷ���ʽΪ��
��3����������Ԫ�ص�����������Ӧˮ�����������ǿ���� ���ѧʽ��
��4��C��E�γɵĻ������о��л�ԭ�Ե��� ���ѧʽ����
��5��A��D���γɻ�����ľ������ͣ� ��
���𰸡���1��![]() ��
��
��2��Al��OH��3+3H+=Al3+3H2O��
��3��HClO4��
��4��SO2��
��5�����Ӿ��壮
�����������������������Ԫ���У�C��E������2�ۣ�������A�壬C��+6����ԭ�Ӱ뾶C��E����CΪ��EΪ����D����1�ۣ�ԭ�Ӱ뾶����������DΪCl��A��B���ϼ۷ֱ�Ϊ+2��+3���ֱ�����A�塢��A�壬ԭ�Ӱ뾶A��B����AΪMg��BΪAl���ݴ˽��
�⣺������Ԫ���У�C��E������2�ۣ�������A�壬C��+6����ԭ�Ӱ뾶C��E����CΪ��EΪ����D����1�ۣ�ԭ�Ӱ뾶����������DΪCl��A��B���ϼ۷ֱ�Ϊ+2��+3���ֱ�����A�塢��A�壬ԭ�Ӱ뾶A��B����AΪMg��BΪAl��
��1��A��E��Ԫ����ɵĻ�����ΪMgO������ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��2��B������������ˮ����ΪAl��OH��3��C������������ˮ����ΪH2SO4�����߷�Ӧ�����ӷ���ʽΪ��Al��OH��3+3H+=Al3+3H2O���ʴ�Ϊ��Al��OH��3+3H+=Al3+3H2O��
��3����������Ԫ����Cl�ķǽ�������ǿ��������������Ӧˮ�����������ǿ���� HClO4���ʴ�Ϊ��HClO4��
��4��C��E�γɵĻ������о��л�ԭ�Ե���SO2���ʴ�Ϊ��SO2��
��5��A��D���γɻ�����ΪMgCl2���������Ӿ��壬�ʴ�Ϊ�����Ӿ��壮

 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�