��Ŀ����
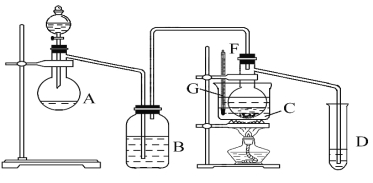
����Ŀ����ͭ���ǹ�ҵ��ͭ����Ҫԭ�ϣ�����Ҫ�ɷ�ΪCuFeS2������һ����Ȼ��ͭ��(��SiO2)��Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ���ͬѧ�������ͼ1ʵ�飺
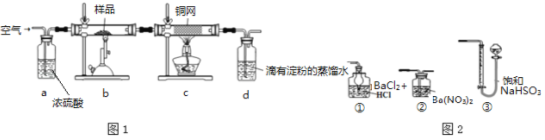
�ֳ�ȡ��ϸ�Ļ�ͭ����Ʒ1.84g���ڿ��������½������գ�����Cu��Fe3O4��SO2���壬ʵ���ȡd����Һ��![]() ������ƿ�У���0.05mol/L������Һ���еζ������ı���Һ20mL����ش��������⣺
������ƿ�У���0.05mol/L������Һ���еζ������ı���Һ20mL����ش��������⣺
(1)����Ʒ��ϸ���ٷ�Ӧ����Ŀ���� ��
(2)װ��a��c�����÷ֱ���_ �� (���ţ����Զ�ѡ)��
a����ȥSO2����
b����ȥ�����е�ˮ����
c��������������
d�������ڹ۲��������
e����ȥ��Ӧ����������
(3)�ζ����յ�ʱ�������� ��
(4)������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ���� ��
(5)ͨ�������֪���û�ͭ��Ĵ���Ϊ ��
��ͬѧ�ڼ�ͬѧʵ��Ļ����ϣ������������ײ�ͬ�����շ������������ղ�������йش�����ͬ��Ҳ����˻�ͭ��Ĵ��ȡ�
(6)����һ������ͼ2װ���������ʵ��װ��d��ͬ�����Դﵽʵ��Ŀ���� (�����)��
(7)����������ԭװ��d�е���Һ��ΪBa(OH)2������õĻ�ͭ��ȴ������+1%��������ʵ����������ȷ�����ܵ�ԭ����Ҫ�� ��
���𰸡�
(1)����Ӵ������ʹԭ�ϳ�ַ�Ӧ���ӿ췴Ӧ����
(2)bd��e
(3)��ƿ�е���Һ����ɫ��Ϊ��ɫ�Ұ���Ӳ���ɫ
(4)ʹ��Ӧ���ɵ�SO2ȫ������dװ���У�ʹ�����ȷ
(5)50%��(6)��
(7)�����е�CO2��Ba(OH)2��Ӧ����BaCO3������BaSO3��������BaSO4��
��������
�����������ʵ��ԭ���ǣ����ݻ�ͭ�����ȷֽ�����Ķ�����������IJⶨ(������������õ�ˮ���궨)�����Ԫ���غ����ȷ����ͭ����������������䴿�ȡ�
(1)����Ʒ��ϸ���ٷ�Ӧ�����������ı������Ŀ����ʹԭ�ϳ�ַ�Ӧ���ӿ췴Ӧ���ʣ��ʴ�Ϊ������Ӵ������ʹԭ�ϳ�ַ�Ӧ���ӿ췴Ӧ���ʣ�
(2)װ��a�е�Ũ����������տ����е�ˮ������ͬʱ����ð�������ݵ����������������ͨ���������ȵ�ͭ�����Գ�ȥ������������ʴ�Ϊ��bd��e��
(3)���ﵽ�ζ��յ�ʱ�����������Ѿ����ⵥ��������ϣ��ٵ���һ�εⵥ�ʣ��������ۻ�����Ұ���Ӳ���ɫ��֤����Ӧ�ﵽ��Ӧ�յ㣬�ʴ�Ϊ����ƿ�е���Һ����ɫ��Ϊ��ɫ�Ұ���Ӳ���ɫ��
(4)��ͭ�����ȷֽ����ɶ��������һϵ�в���ֽ���Ϻ���Ȼͨ����������Խ������Ķ�������ȫ���ų�ȥ��ʹ�����ȷ���ʴ�Ϊ��ʹ��Ӧ���ɵ�SO2ȫ������dװ���У�ʹ�����ȷ��
(5)���ݵζ��ܵ�ʾ�����Ϸ�С���·����Զ����ζ���ʾ����20.00mL�����ﵽ�ζ��յ�ʱ�����������Ѿ����ⵥ��������ϣ��ٵ���һ�εⵥ�ʣ��������ۻ���������ݷ�Ӧʵ�ʣ��õ���2I2��2SO2��CuFeS2�����ĵ�0.05mol/L������Һ20.00mLʱ�������ĵĵⵥ�ʵ���Ϊ��0.05mol/L��0.02L=0.0010mol�����Ի�ͭ��������ǣ�0.5��0.0010mol��184g/mol��10=0.92g�������䴿���ǣ�![]() ��100%=50%���ʴ�Ϊ��50%��
��100%=50%���ʴ�Ϊ��50%��
(6)����ͼ2�У������ᱵ��Һ��ͨ����������ܹ��������ᱵ���������˸���������ᱵ���������������������������ʴ�Ϊ������
(7)�����е�CO2��Ba(OH)2��Ӧ��������BaCO3����������BaSO3��������BaSO4�����Ե������Եij��������ȶ������������������Ӧ���ɵİ�ɫ���������࣬�ʴ�Ϊ�������е�CO2��Ba(OH)2��Ӧ����BaCO3������BaSO3��������BaSO4��

 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���������������Ϣ���ɣ��±����������ֶ����ڵ�ԭ�Ӱ뾶����Ҫ���ϼۣ���֪���ԭ�Ӱ뾶Ϊ0.089nm��
Ԫ�ش��� | A | B | C | D | E |
ԭ�Ӱ뾶/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
��Ҫ���ϼ� | +2 | +3 | +6����2 | ��1 | ��2 |
��1��A��E��Ԫ����ɵĻ�����ĵ���ʽ ��
��2��B������������ˮ������C������������ˮ���ﷴӦ�����ӷ���ʽΪ��
��3����������Ԫ�ص�����������Ӧˮ�����������ǿ���� ���ѧʽ��
��4��C��E�γɵĻ������о��л�ԭ�Ե��� ���ѧʽ����
��5��A��D���γɻ�����ľ������ͣ� ��