题目内容
【题目】Ⅰ:现有如下物质:①酒精、②铜、③氢氧化钡、④氨气、⑤蔗糖、 ⑥高氯酸、⑦碳酸氢钠、⑧磷酸、⑨硫化氢、⑩Al2(SO4)3。请用物质的序号填写下列空白
(1)属于强电解质的有: 。
(2)液态时能导电且为物理变化的有: 。
(3)⑦在水溶液的电离方程式为 。
Ⅱ:A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
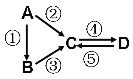
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。处理C物质可得到有价值的化学品,写出该化学品中的1种酸和1种盐的名称 、 。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是___ _____。写④反应离子方程 。
(4)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式 。
【答案】Ⅰ:(1)③⑥⑦⑩ (2)2 (3)NaHCO3=Na + HCO3-
Ⅱ:(1)硫酸、硫酸铵(或硫酸钙等) (2)4NH3+6NO![]() 5N2+6H2O;
5N2+6H2O;
(3)第三周期ⅢA族AlO2-+2H2O+CO2=Al(OH)3↓+HCO3- (4)Cu+2Fe3+=Cu2++2Fe2+
【解析】
试题分析:Ⅰ.(1)①酒精、④氨、⑤蔗糖在水溶液和熔融状态下都不导电,属于非电解质;②铜是单质,既不是电解质又不是非电解质;③氢氧化钡、⑥高氯酸、⑦碳酸氢钠、⑩Al2(SO4)3 在水溶液中能够完全电离,属于强电解质;⑧磷酸、⑨硫化氢水溶液中只能部分电离,属于弱电解质;故答案为:③⑥⑦⑩;
(2)②铜中含有自由移动的电子,导电时电子定向移动,没有新物质的生成,属于物理变化,故选:②;
(3)碳酸氢钠属于盐在水中完全电离出钠离子与碳酸氢根离子,电离方程式为NaHCO3=Na++HCO3-;
Ⅱ.(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质判断为SO2.所以A为S,C为SO2,B为H2S,D为SO3,处理C物质可得到有价值的化学品,所以利用二氧化硫可以制取硫酸,用碱吸收得到硫酸铵等;
(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染,判断为NO、NO2.B与C在一定条件下反应生成的A是大气主要成分,推断A为N2,B为NH3,该反应的化学方程式4NH3+6NO![]() 5N2+6H2O;
5N2+6H2O;
(3)若D物质具有两性,④反应是通入过量的一种引起温室效应的主要气体,推断D为Al(OH)3,说明C为偏铝酸钠NaAlO2,②③反应均要用强碱溶液,判断单质A为Al,B为铝盐,Al元素在周期表中的位置是第三周期ⅢA族,④反应离子方程式:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;
(4)若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质.推断为Cl2,C的溶液用于蚀刻印刷铜电路板,判断C为FeCl3,D为FeCl2,C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、﹣2 | ﹣1 | ﹣2 |
(1)A和E两元素组成的化合物的电子式 .
(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是 (填化学式)
(4)C和E形成的化合物中具有还原性的是 (填化学式).
(5)A和D所形成化合物的晶体类型: .