题目内容
常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水④pH=11的NaOH溶液。下列说法正确的是
| A.若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② |
| B.③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ |
| C.①与②分别与足量镁粉反应,生成H2的量:①<② |
| D.②和③混合,所得混合溶液的pH大于7 |
D
试题分析:强酸、强碱完全电离,弱酸、弱碱部分电离。当溶液的PH相同C(CH3COOH)> C(HCl) ;C(NH3·H2O) > C(NaOH). 若将溶液稀释相同倍数,弱酸或弱碱的PH变化较小。故溶液pH大小顺序:③>④>②>①A错误。如果溶液的体积相同,则n(CH3COOH)> n(HCl);n(NH3·H2O) > n(NaOH). B.③和④分别用等浓度的硫酸溶液中和,由于n(NH3·H2O) > n(NaOH).消耗硫酸溶液的体积:③>④。错误。C.①与②分别与足量镁粉反应,由于n(CH3COOH)> n(HCl)生成H2的量:② <①。错误。D.②pH=3的盐酸C(H+)= 10-3mol/L;③pH=11的氨水C(OH-)=10-3mol/L盐酸是强酸完全电离,一水合氨是弱碱部分电离.C(HCl)= C(H+), C(NH3·H2O) > C(OH-)= C(HCl).混合,②和③混合,因为碱过量,所以所得混合溶液的pH大于7。正确。

练习册系列答案
相关题目
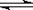 H+ + OH-。下列叙述中,正确的是
H+ + OH-。下列叙述中,正确的是 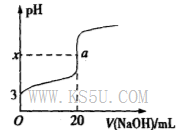
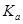 =____________mol/L。
=____________mol/L。