题目内容
酸碱中和滴定在生产实际中有着广泛的应用。室温时,用0.250 mol/LNaOH溶液滴定25.0 mL的一元酸HR溶液时,溶液的pH变化情况如图所示,其中a点表示两种物质恰好完全反应。请回答下列问题:
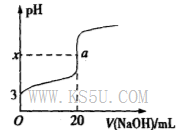
(1)该一元酸HR溶液的物质的量浓度为_______________。
(2)图中x_____7(填“>”、“<”或“=”),其原因是___________________(用离子方程式表示)。
(3)滴定到a点时,溶液中c(OH-)--c(HR)="____mol/L" (用含x的代数式表示)。
(4)室温时,HR的电离常数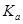 =____________mol/L。
=____________mol/L。

(1)该一元酸HR溶液的物质的量浓度为_______________。
(2)图中x_____7(填“>”、“<”或“=”),其原因是___________________(用离子方程式表示)。
(3)滴定到a点时,溶液中c(OH-)--c(HR)="____mol/L" (用含x的代数式表示)。
(4)室温时,HR的电离常数
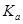 =____________mol/L。
=____________mol/L。(1)0.20mol/L (2)> R-+H2O HR+OH- (3)10-x (4)5.0×10-6
HR+OH- (3)10-x (4)5.0×10-6
 HR+OH- (3)10-x (4)5.0×10-6
HR+OH- (3)10-x (4)5.0×10-6试题分析:(1)由于酸碱恰好发生中和反应时:n(NaOH)=n(HR),所以20ml×0.250 mol/L="25.0" mL×C(HR) mol/L,解得C(HR)= 0.20mol/L.(2)反应开始时C(H+)=10-3mol/L<C(HR) =0.20mol/L,说明HR为弱酸。二者恰好反应时生成的盐为强碱弱酸盐,在溶液中发生反应:R-+H2O
 HR+OH-,所以图中X>7,,溶液显碱性。(3)恰好中和时PH=X。C(H+)=10-Xmol/L,则C(OH-)(总)=KW÷C(H+)=10-14÷10-X=10(X-14)
HR+OH-,所以图中X>7,,溶液显碱性。(3)恰好中和时PH=X。C(H+)=10-Xmol/L,则C(OH-)(总)=KW÷C(H+)=10-14÷10-X=10(X-14)C(OH-)(总)=C(OH-)(水电离)+C(OH-)(水解)=C(H+)+C(HR),所以C(OH-)(总) --C(HR) =C(H+)=10-Xmol/L。
(4)室温时,在溶液中存在电离平衡HR
 H++R-,电离常数Ka={C(H+)·C(R-)}÷C(HR)={10-3 mol/L×10-3 mol/L}÷{0.20mol/L-10-3 mol/L }=5.0×10-6 mol/L。
H++R-,电离常数Ka={C(H+)·C(R-)}÷C(HR)={10-3 mol/L×10-3 mol/L}÷{0.20mol/L-10-3 mol/L }=5.0×10-6 mol/L。
练习册系列答案
相关题目
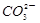 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3) H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是 H++OH-,在25℃、35℃时其离子积分别为
H++OH-,在25℃、35℃时其离子积分别为