题目内容
已知水的电离方程式:H2O 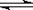 H+ + OH-。下列叙述中,正确的是
H+ + OH-。下列叙述中,正确的是
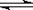 H+ + OH-。下列叙述中,正确的是
H+ + OH-。下列叙述中,正确的是 | A.升高温度,KW增大,pH不变 |
| B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 |
| C.向水中加入少量硫酸,c(H+)增大,KW不变 |
| D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
C
试题分析:A.升高温度,KW增大,C(H+)增大,溶液 的pH减小。错误。B.向水中加入氨水,由于氨水中的电解质一水合氨会发生电离:NH3?H2O
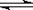 NH4++OH-。增加氢氧根离子的浓度,对水的电离平衡起到了抑制作用。使水的电离平衡向逆向移动。水中的氢离子和氢氧根离子的浓度不再相等,最终 溶液中的c(OH-)比原来大。错误。C. 向水中加入少量硫酸,对水的电离平衡起到了抑制作用,但平衡移动的趋势是很微弱的,最后溶液显酸性。c(H+)增大,由于溶液中的KW只与温度有关。温度不变,Kw就不变。正确。D.向水中加入少量固体CH3COONa, CH3COO-会与水电离产生的氢离子结合成弱电解质CH3COOH,促进了水的电离,使水继续电离直至新的平衡状态。最后由于C(OH-)>C(H+).所以溶液显碱性。错误。
NH4++OH-。增加氢氧根离子的浓度,对水的电离平衡起到了抑制作用。使水的电离平衡向逆向移动。水中的氢离子和氢氧根离子的浓度不再相等,最终 溶液中的c(OH-)比原来大。错误。C. 向水中加入少量硫酸,对水的电离平衡起到了抑制作用,但平衡移动的趋势是很微弱的,最后溶液显酸性。c(H+)增大,由于溶液中的KW只与温度有关。温度不变,Kw就不变。正确。D.向水中加入少量固体CH3COONa, CH3COO-会与水电离产生的氢离子结合成弱电解质CH3COOH,促进了水的电离,使水继续电离直至新的平衡状态。最后由于C(OH-)>C(H+).所以溶液显碱性。错误。
练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
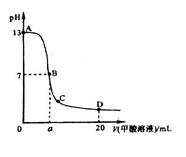
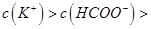
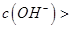
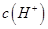
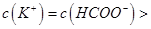
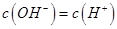 ,且a=7.5
,且a=7.5