题目内容
7.金属钠分别在过量的O2和Cl2中燃烧,产生的现象相同点是( )| A. | 都产生白烟 | B. | 都发生爆炸 | C. | 都产生黄色火焰 | D. | 都生成白色固体 |
分析 金属钠在过量的Cl2中燃烧苍白色火焰,并有大量白烟(氯化钠)生成,火焰呈黄色,而在氧气中燃烧生成淡黄色的固体,火焰呈黄色,由此分析解答.
解答 解:金属钠在过量的Cl2中燃烧苍白色火焰,并有大量白烟(氯化钠)生成,火焰呈黄色,而在氧气中燃烧生成淡黄色的固体,火焰呈黄色,产生的现象相同点是都产生黄色火焰,故选C.
点评 本题考查钠的化学性质,学生只要掌握钠与非金属反应的现象和焰色反应的相关知识就可以迅速解题,比较容易.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17. 减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
①已知:K(300℃)>K(350℃),则该反应是放热反应(填“放热”或“吸热”)
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有D
A.升高温度 B.恒容充入氦气 C.恒容再充入NO2 D.把恒容改为恒压,其它条件相同.
 减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有D
A.升高温度 B.恒容充入氦气 C.恒容再充入NO2 D.把恒容改为恒压,其它条件相同.
18.下列事实不能说明有机物分子中原子或原子团直接相连时而产生相互影响的是( )
| A. | 邻甲基苯酚能与NaOH溶液反应而苯甲醇不能 | |
| B. | 等物质的量的乙醇和乙二醇与足量的金属钠反应,后者产生的氢气比前者多 | |
| C. | 苯与液溴在催化剂存在下发生反应,而苯酚与浓溴水混合就能发生反应 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色而甲烷不能 |
15.化学是以实验为基础的学科,下列各图示实验不合理的是( )
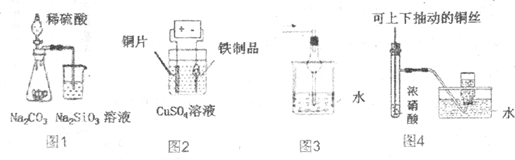

| A. | 图1为证明非金属性强弱:S>C>Si | |
| B. | 图2为在铁制品表面镀铜 | |
| C. | 图3可用于吸收氯化氢、溴化氢等气体 | |
| D. | 图4为制备并收集少量NO2气体 |
2.设NA为阿伏加德罗常数,下列说法中,正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16gCH4所含原子数目为NA | ||
| C. | 17gNH3所含电子数目为10NA | D. | 18g水所含分子数目为NA |
19.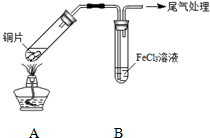 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
FeCl3溶液显酸性的原因是Fe3++3H2O?Fe(OH)3+3H+.写出装置A中产生SO2的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为生成蓝色沉淀.
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
| 步骤② | 往5mL 1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
16.在盐类的水解过程中,下列叙述不正确的是( )
| A. | 所有的盐溶液均呈中性 | |
| B. | 盐类的水解过程破坏了纯水的电离平衡 | |
| C. | 盐类的水解是酸碱中和反应的逆反应 | |
| D. | 升高温度可以促进盐类的水解 |
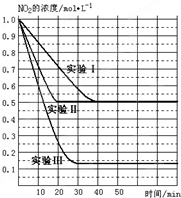 某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?
某条件下,在2L密闭容器中充入NO2发生如下反应:2NO2(g)?