题目内容
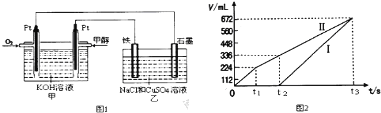
【题目】某同学设计了一个甲醇(CH3OH)燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图1:
(1)25℃,1.01×105Pa时16g液态甲醇完全燃烧,当恢复至原状态时,放出362.9kJ热量,此反应的热化学方程式为 。
(2)写出甲中通入甲醇这一极的电极反应式 。
(3)铁电极上反应的现象为:先有红色的物质析出,后 。
石墨电极上产生的气体是 。
(4)理论上乙中两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积)原混合溶液中CuSO4的物质的量浓度 mol·L-1。(假设溶液体积不变)
【答案】(1)2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(l) ΔH=-1451.6KJ/mol
(2)CH3OH - 6e-+ 8OH- = CO32 -+ 6H2O
(3)有气泡产生 Cl2、O2
(4) 0.1
【解析】
试题分析:(1)16g液态甲醇完全燃烧,即16/32 =0.5mol的甲醇对应362.9kJ热量,据化学方程式,放出热量4x362.9=1451.6, 热化学方程式为2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(l) ΔH=-1451.6KJ/mol
(2)在燃料电池的中,负极上是燃料发生失电子的氧化反应,在碱性环境下,甲醇失电子的过程为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)石墨为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,随着电解的继续,变成电解水放出氢气和氧气。
(4)图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,
由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=(0.224/22.4) ×2=0.02mol,所以c(NaCl)=0.02/0.2=0.1mol/L,
由t2时生成氧气为112mL,n(O2)=0.112/22.4=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,
根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=0.04mol/2=0.02mol,所以c(CuSO=0.02mol/0.2L=0.1mol/L,