题目内容
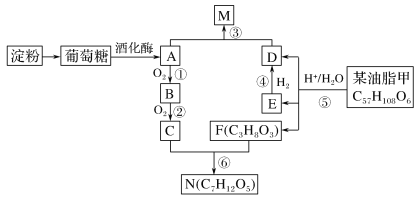
【题目】有关物质的转化关系如图所示(部分条件已略去)。 A为海水中含量最高的盐类物质, C 为黄绿色气体, F为生活中常见的金属单质, I为红褐色沉淀。

(1)E的化学式为_____,I的名称为_______;
(2)写出D的电子式_______;
(3)写出反应①的化学方程式:______;写出反应⑤的离子方程式:_________。
(4)检验H溶液中金属阳离子的方法是_____________。
(5)保存G溶液时要加少量固体 F 的原因是_______________。
【答案】HCl 氢氧化铁 ![]() 2NaCl+2H2O
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 2Fe2++Cl2=2Fe3++2Cl- 取少量H溶液于试管中,滴加KSCN溶液,若溶液变为血红色,则溶液中含Fe3+ 防止Fe2+被氧化
2NaOH+H2↑+Cl2↑ 2Fe2++Cl2=2Fe3++2Cl- 取少量H溶液于试管中,滴加KSCN溶液,若溶液变为血红色,则溶液中含Fe3+ 防止Fe2+被氧化
【解析】
A是海水中含量最高的盐,则A为NaCl,电解NaCl溶液生成H2、Cl2与NaOH,而C为黄绿色气体,则C为Cl2,B与C反应生成E,E的溶液与金属F生成G,G能与氯气反应生成H,而H与D反应生成红褐色沉淀I,可知金属F为Fe,B为H2,E为HCl,G为FeCl2,H为FeCl3,I为Fe(OH)3,据此分析解答。
根据上述分析可知:A是NaCl,B是H2,C是Cl2,D是NaOH,E 是HCl,F是Fe,G为FeCl2,H为FeCl3,I为Fe(OH)3。
(1)E的化学式为HCl,I的化学式为Fe(OH)3,名称为氢氧化铁;
(2)D是NaOH,该物质是离子化合物,电子式为:![]() ;
;
(3)反应①是电解NaCl溶液,反应产生NaOH、Cl2、H2,该反应的化学方程式:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;反应⑤是FeCl2被氯气氧化为FeCl3,反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-;
2NaOH+H2↑+Cl2↑;反应⑤是FeCl2被氯气氧化为FeCl3,反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-;
(4)H溶液中含有Fe3+,检验FeCl3溶液中金属阳离子的方法是:取少量H溶液于试管中,向其中滴加少量KSCN溶液,若溶液变为血红色,则溶液中含Fe3+;
(5)G为FeCl2,由于空气在溶液中溶解,会导致部分Fe2+变为Fe3+,保存FeCl2溶液时要加少量固体 Fe 的原因是:防止Fe2+被氧化。