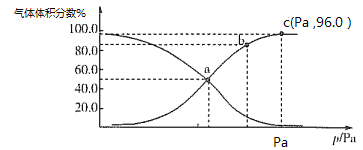
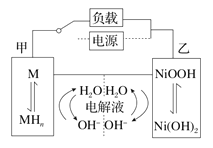
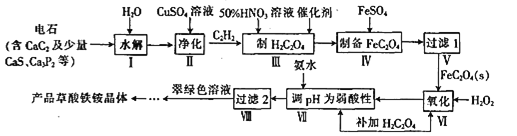
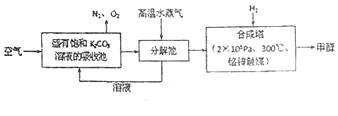
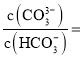题目内容
【题目】Cu可形成多种配合物,某同学在探究配合物的形成时做了以下实验,根据下列信息回答问题:
(1)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色的透明溶液,请写出先后发生反应的离子方程式___________。
(2)再向深蓝色透明溶液加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为__________________。
(3)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3________(填“>”“=”或“<”)H2O。
(4)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,某同学设计了如下实验:
a、分别取等质量的两种配合物晶体的样品配成待测溶液;
b、分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c、沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。绿色晶体配合物的化学式为____________,由Cl所形成的化学键类型是_____________。
。绿色晶体配合物的化学式为____________,由Cl所形成的化学键类型是_____________。
【答案】Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O [Cu(NH3)4]SO4·H2O > [TiCl(H2O)5]Cl2·H2O 离子键和配位键
【解析】
(1)硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物,根据反应写出离子反应方程式;
(2)[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体[Cu(NH3)4]SO4;
(3)根据向盛有硫酸铜水溶液的试管里逐滴加入过量氨水,生成了[Cu(NH3)4]2离子判断;
(4)在配合物中的氯原子是不能自由移动的,但配离子中可以形成氯离子,氯离子可以与银离子反应生成氯化银白色沉淀,根据沉淀情况可以得到有几个离子在配合物中。
(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O;
(2)再向深蓝色透明溶液加入乙醇,由于[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体:Cu(NH3)4SO4H2O,故答案为:Cu(NH3)4SO4H2O;
(3)硫酸铜溶液中加入过量氨水后生成了[Cu(NH3)4]2离子,说明氨气与Cu2+的配位能力大于水与铜离子的配位能力,故答案为:>;沉淀的质量可以推断出氯离子的含量,原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() ,两种晶体的组成皆为TiCl36H2O,说明紫色晶体中有三个自由移动的氯离子,而绿色晶体中只有2个自由移动的离子,即有一个氯原子形成了配合物,因为钛为6配位,即配合物中须有五个水,即化学式为[TiCl(H2O)5]Cl2H2O,而紫色晶体的化学式为[Ti(H2O)6]Cl3,根据其化学式知,由Cl所形成的化学键类型是离子键和共价键,故答案为:[TiCl(H2O)5]Cl2H2O;离子键和共价键。
,两种晶体的组成皆为TiCl36H2O,说明紫色晶体中有三个自由移动的氯离子,而绿色晶体中只有2个自由移动的离子,即有一个氯原子形成了配合物,因为钛为6配位,即配合物中须有五个水,即化学式为[TiCl(H2O)5]Cl2H2O,而紫色晶体的化学式为[Ti(H2O)6]Cl3,根据其化学式知,由Cl所形成的化学键类型是离子键和共价键,故答案为:[TiCl(H2O)5]Cl2H2O;离子键和共价键。

 阅读快车系列答案
阅读快车系列答案【题目】欲测定某NaOH溶液的物质的量浓度,可用0.100 0 mol·L-1的HCl标准溶液滴定待测碱(用甲基橙作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为________。
(2)滴定至终点的颜色变化为____________。
(3)若甲学生在实验过程中做了三组平行实验,数据记录如下,则此时消耗标准溶液的体积为__________。计算出待测NaOH溶液的物质的量浓度为______。(保留四位有效数字)
实验 序号 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1 HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |