题目内容
【题目】化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是( )
A.稀盐酸溶液与稀氢氧化钠的中和热:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ· mol-1
B.FeCl3溶液水解的离子方程式:Fe3++3H2O![]() Fe (OH)3+3H+
Fe (OH)3+3H+
C.热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1,一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中反应生成NH3(g),则放热19.3kJ
2NH3(g) △H=-38.6kJ·mol-1,一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中反应生成NH3(g),则放热19.3kJ
D.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g) ΔH=+566.0 kJ·mol-1
【答案】C
【解析】
A. 强酸强碱的稀溶液发生中和反应生成1mol水时放出的热量为中和热;
B. Fe3+水解生成弱电解质Fe (OH)3,使溶液呈弱酸性;
C. 合成氨的反应为可逆反应,不能进行到底;
D. 1molCO完全燃烧,生成CO2时放出的热量为283.0 kJ;
A. 强酸强碱的稀溶液发生中和反应生成1mol水时放出的热量为中和热,因此稀盐酸溶液与稀氢氧化钠的中和热方程式为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ· mol-1,A项正确,不符合题意;
B. Fe3+水解生成弱电解质Fe (OH)3,使溶液呈弱酸性,离子方程式为:Fe3++3H2O![]() Fe (OH)3+3H+,B项正确,不符合题意;
Fe (OH)3+3H+,B项正确,不符合题意;
C. 合成氨的反应为可逆反应,不能进行到底,因此一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中反应生成NH3(g),则放出的热量小于19.3kJ,C项错误,符合题意;
D. 1molCO完全燃烧,生成CO2时放出的热量为283.0 kJ,那么2CO2(g)=2CO(g)+O2(g) ΔH=+566.0 kJ·mol-1,D项正确,不符合题意;
答案选C。

【题目】常温下,几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp |
|
|
|
|
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜先加入_______(填试剂分子式),然后调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________。
(2)在有CuCl与CuI固体共存的悬浊液中,C(Cl-)______C(I-)(填 > < =)
某溶液中C(Cl-)为0.0001 mol·L-1, C(I-)为0.1 mol·L-1,往溶液中滴加硝酸亚铜,先产生的沉淀是__________(填沉淀化学式)
【题目】氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业 和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期 IIIA 族,化学性质与铝元素相似。
(1)如图是当反应器中按 n(N2):n(H2)=1:3 投料后,在 200℃、400℃、600℃下,反应达到平衡时,混合物中 NH3的物质的量分数随压强的变化曲线。
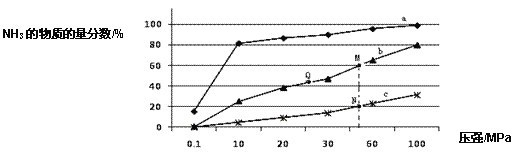
①曲线 a 对应的温度是_____________。
②关于工业合成氨的反应,下列叙述正确的是____________(填字母)。
A.及时分离出 NH3 可以提高 H2 的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中 M、N、Q 点平衡常数 K 的大小关系是 K(M) = K(Q) >K(N)
③M 点对应的 H2 转化率是____________。
(2)工业上利用 Ga 与 NH3 合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成 3 mol H2 时就会放出30.8 kJ 的热。
①该反应的热化学方程式是____________________。
②反应的化学平衡常数表达式是____________。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是____________。
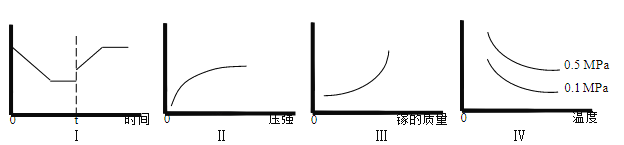
A.I 图像中如果纵坐标为正反应速率,则 t 时刻改变的条件可以为升温
B.II 图像中纵坐标可以为镓的转化率
C.III 图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的 NaOH 溶液中,该反应的离子方程式是:___________________。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液 X。己知:
Al(OH)3 | Ga(OH)3 | |
酸式电离常数 Ka | 2×10- 11 | 1×10- 7 |
碱式电离常数 Kb | 1.3×10- 33 | 1.4×10- 34 |
往 X 溶液中缓缓通入 CO2,最先析出的氢氧化物是____________。
(4)工业上以电解精炼法提炼镓的原理如下:以待提纯的粗镓(内含 Zn、Fe、Cu 杂质)为阳极,以高纯镓为阴极,以 NaOH 水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技 术到达阴极并在阴极放电析出高纯镓。
①己知离子氧化性顺序为:Zn2+<Ga3+< Fe2+<Cu2+,电解精炼镓时阳极泥的成分是____________。
②GaO2- 在阴极放电的电极方程式是___________。