��Ŀ����
����Ŀ��T��ʱ��2L�ܱ�������ʹX(g)��Y(g)������Ӧ����Z(g)����Ӧ������X��Y��Z��Ũ�ȱ仯��ͼ1��ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��Y��ת������ʱ��Ĺ�ϵ��ͼ2��ʾ�������н��۲���ȷ���ǣ� ��
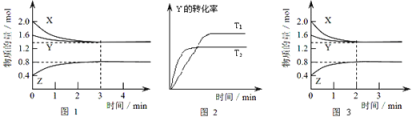
A.�����з����ķ�Ӧ�ɱ�ʾΪ��3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.��Ӧ���е�ǰ3min�ڣ���X��ʾ�ķ�Ӧ����v(X)=0.3mol/(L��min)
C.���������������䣬�����¶ȣ���Ӧ�Ļ�ѧƽ�ⳣ��K��С
D.���ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı��������ʹ�ô���
���𰸡�B
��������
A����ͼ1֪��X�����ʵ���������Ϊ(2.0-1.4)mol=0.6mol��Y�����ʵ���������Ϊ(1.6-1.4)mol=0.2mol��X��YΪ��Ӧ�Z�����ʵ���������Ϊ(0.8-0.4)mol=0.4mol��ZΪ�����ͬһ��ѧ��Ӧͬһʱ����ڣ���Ӧ����ٵ����ʵ��������������ӵ����ʵ���֮�ȵ����������֮�ȣ�����X��Y��Z�ļ�����֮��=0.6mol��0.2mol��0.4mol=3��1��2�����Է�Ӧ�ɱ�ʾΪ��3X(g)+Y(g)2Z(g)����A��ȷ��
B����Ӧ���е�ǰ3min�ڣ���X��ʾ�ķ�Ӧ����v(X)= =0.1mol/(L��min)����B����
=0.1mol/(L��min)����B����
C����ͼ2֪�����ȹ���ƽ��ֵ����������T2��T1�������¶ȣ�Y��ת���ʼ��٣�ƽ�����淴Ӧ�����ƶ������������¶ȣ�ƽ�ⳣ����С����C��ȷ��
D��ͼ3��ͼ1�Ƚϣ�ͼ3����ƽ�����õ�ʱ��϶̣�˵����Ӧ��������ƽ��״̬û�з����ı䣬˵�����Ǹı��¶ȵĽ�����÷�Ӧ����Ӧ���������ʵ�����С�ķ�Ӧ��Ҳ���Ǹı�ѹǿ(��Ũ��)�Ľ����Ӧ�Ǽ�������Ľ������D��ȷ��
��ѡB��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�