题目内容
在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g) 2HI(g),已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0. 2 mol/L,则平衡时H2的浓度是( )
2HI(g),已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0. 2 mol/L,则平衡时H2的浓度是( )
 2HI(g),已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0. 2 mol/L,则平衡时H2的浓度是( )
2HI(g),已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0. 2 mol/L,则平衡时H2的浓度是( )| A.0.32 mol/L | B.0.16 mol/L | C.0.08 mol/L | D.0.04 mol/L |
D
试题分析:H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI的浓度为0.16 mol/L,氢气和碘平衡浓度分别为0.02mol/L、0.02mol/L。HI体积分数为0.16/0.2=80%。
若起始时氢气和碘的浓度均变为0.2mol/L,因该反应是反应前后计量数不变的反应,起始投料量比值相等,则两个平衡为等效平衡。设平衡时HI浓度为2x,则2x/0.4=80%,x=0.16,平衡时氢气浓度为0.04mol/L。
点评:室温定容时,反应前后化学计量数不变的反应,若起始投料量比值相等,则两平衡等效。

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是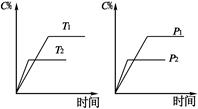
 NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+ K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是 B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是  2C(g)(正反应放热)中,为了增大A的转化率,应采用的反应条件是( )
2C(g)(正反应放热)中,为了增大A的转化率,应采用的反应条件是( ) C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: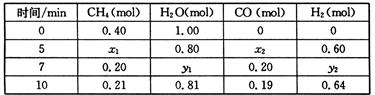
 CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol?L-1,c(H2O)=6.0mol?L-1,c(CO2)=3.0mol?L-1,c(H2)= 4.5mol?L-1,则此时该反应向_________方向移动。
CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol?L-1,c(H2O)=6.0mol?L-1,c(CO2)=3.0mol?L-1,c(H2)= 4.5mol?L-1,则此时该反应向_________方向移动。