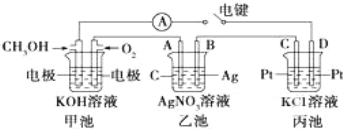
题目内容
【题目】下列有关溶液中粒子浓度的关系式中,正确的是( )
A.pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
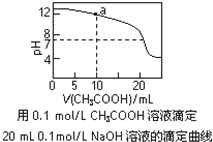
C.图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
D.图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
【答案】C
【解析】
A.pH相同的钠盐溶液中,弱根离子水解程度越大,其盐溶液浓度越小,碳酸钠的水解程度大于碳酸氢钠,大于醋酸钠,则当三种溶液的pH相同时,其物质的量浓度由大到小的顺序是③<②<①,钠离子浓度大小顺序是③<②<①,故A错误;
B.根据物料守恒得c(Na+)=c(A2-)+c(HA-)+c(H2A),故B错误;
C.a点溶液中存在的溶质是等物质的量的醋酸钠和氢氧化钠,根据物料守恒得c(Na+)=2c(CH3COO-)+2c(CH3COOH),根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以得c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故C正确;
D.pH=7时c(OH-)=c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以得c(Na+)=c(CH3COO-),故D错误;
故选:C。

【题目】已知0.1mol/LH2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl溶液 |
10% | 29% | 1.33% | 100% |
(1)写出H2SO4在水中的电离方程式___。
(2)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为___。
(3)根据题设条件计算CH3COOH的电离常数Ka=___。若常温下,将bmol·L–1的CH3COONa液与0.01mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka=___。