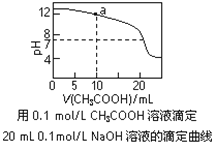
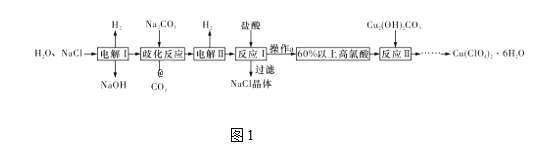
题目内容
【题目】在建国70周年阅兵仪式上,“歼20”“东风—41核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)早期战斗机主要采用铝合金,其中超硬铝属Al—Cu—Mg—Zn系。Cu在元素周期表中的位置是___,比较第一电离能Mg___Al(填“>”“<”“=”)。
(2)金属Zn中的原子采取___最密堆积。
(3)中期战斗机主要采用钛合金,Ti的价电子排布图为___。钛晶体在882℃以上为体心立方的β钛,其中钛原子的配位数为___。
(4)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成Ti(SO4)2、NiSO4,其中阴离子的立体构型为___,S的___杂化轨道与O的2p轨道形成___键(填“π”或“σ”)。
(5)隐形战机采用Fe(CO)5(羰基铁)作为吸波材料,羰基铁在常温下为红棕色液体,固体羰基铁属于___晶体,CO与Fe之间的化学键称为___。与CO互为等电子体的分子或离子是___(只写一种)。
(6)一种钛镍合金的立方晶胞结构如图所示,若晶胞的边长为apm,则晶胞的密度为___g/cm3(用含a、NA的计算式表示)。

【答案】第四周期IB族 > 六方  8 正四面体 sp3 σ 分子 配位键 N2或CN-
8 正四面体 sp3 σ 分子 配位键 N2或CN- ![]()
【解析】
根据元素的价电子排布得出价电子排布图,并判断元素位置,结合原子半径分析第一电离能大小;根据杂化轨道互斥理论判断粒子空间构型;根据等电子体的概念书写与CO互为等电子体的分子或离子,利用均摊法和相关公式进行晶胞密度的计算。
(1)Cu为29号元素,价电子3d104s1,在元素周期表中的位置是第四周期IB族,同周期,第一电离能从左到右呈增大趋势,但第IIA族的s轨道为全充满状态,因此第一电离能Mg>Al;故答案为:第四周期IB族;>;
(2)金属锌中的Zn原子的配位数为12,采用六方最密堆积,故答案为:六方;
(3)Ti为22号元素,其价电子排布式为3d24s2,则价电子排布图为 ,钛晶体在882℃以上为体心立方的β钛,其中钛原子的配位数为8;故答案为:
,钛晶体在882℃以上为体心立方的β钛,其中钛原子的配位数为8;故答案为: ;8;
;8;
(4)Ti(SO4)2、NiSO4其中阴离子的价层电子对数为![]() ,其立体构型为正四面体形,S是sp3杂化,杂化轨道都是形成σ键,因此S的sp3杂化轨道与O的2p轨道形成σ键;故答案为:正四面体;sp3;σ;
,其立体构型为正四面体形,S是sp3杂化,杂化轨道都是形成σ键,因此S的sp3杂化轨道与O的2p轨道形成σ键;故答案为:正四面体;sp3;σ;
(5)隐形战机采用Fe(CO)5(羰基铁)作为吸波材料,羰基铁在常温下为红棕色液体,说明熔点低,固体羰基铁属于分子晶体,CO与Fe之间的形成的化学键称为配位键,因为价电子C和N+相同,N和O+相同,所以与CO互为等电子体的分子或离子是N2或CN-;故答案为:分子;配位键;N2或CN-;
(6)根据钛镍合金的立方晶胞结构得到Ti的个数为![]() ,Ni的个数为
,Ni的个数为![]() ,若晶胞的边长为apm,则晶胞的密度为
,若晶胞的边长为apm,则晶胞的密度为 ;故答案为:
;故答案为:![]() 。
。