题目内容
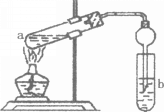
【题目】已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:

(1)通入CO2前,灯泡________(填“亮”或“不亮”)。
(2)开始通入CO2时,灯泡的亮度________。
(3)继续通入过量的CO2,灯泡的亮度________。
(4)下列四个图中,________(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。

【答案】亮先变暗后熄灭熄灭后又逐渐变亮D
【解析】
(1)因为Ca(OH)2是强电解质,溶于水后完全电离出离子,溶液中离子的浓度比较大,故灯泡亮;
(2)开始通入二氧化碳时,发生反应:CO2+Ca(OH)2=CaCO3↓+H2O,生成的沉淀和水使溶液中自由移动的离子减少,离子浓度减小,灯泡逐渐变暗直至熄灭;
(3)继续通入二氧化碳,发生反应:CaCO3+CO2+H2O=Ca(HCO3)2,生成的Ca(HCO3)2易溶于水且完全电离出自由移动的离子,溶液中离子浓度增大,灯泡又开始逐渐变亮;
(4)由于通入CO2后溶液中自由移动的离子的浓度逐渐减小,所以一开始导电能力逐渐下降至变为0,然后随着反应的进行,离子浓度逐渐增大,导电能力又逐渐增大,当溶液中反应完全后,溶液导电能力保持不变,故D图形符合。

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目