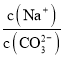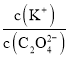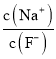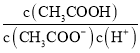题目内容
【题目】(1)许多金属元素有焰色反应,金属存在焰色反应的原因是___________________________。
(2)基态铝原子中,有______种电子运动状态,其中p轨道的电子云轮廓图的形状为_______。
(3)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
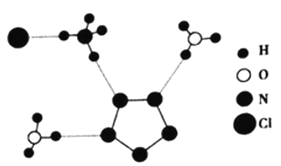
①图中R中阳离子是______(填写化学式),相对分子质量较大的阳离子中心原子的杂化类型是____。
②图中R中阴离子N5-中的σ键总数为___________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N5- 中的大π键应表示为___________。
),则N5- 中的大π键应表示为___________。
(4)氮与铝之间形成化合物X,具有耐高温抗冲击等性能。X的晶体结构如图所示。
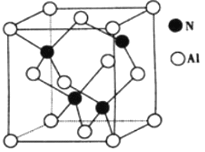
①已知氮化硼与X晶体类型相同,推测氮化硼的熔点比X的熔点___________(填“高”、“低“ ) ,可能的原因是_________________________________________。
②若X的密度为ρg·cm-3,则晶体中最近的两个Al原子的距离为___________cm。(阿伏加德罗常数的值用NA表示)
【答案】 高能级上的电子跃迁到低能级释放能量 13 纺锤形或哑铃型 NH4+、H3O+ sp3 5 ![]() 高 氮化硼中的共价键能大于氮化铝中的键能
高 氮化硼中的共价键能大于氮化铝中的键能 ![]() ×
×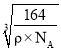 ×
×![]()
【解析】(1)当含某金属元素的物质在火焰上灼烧时,焰色反应原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,同时将多余能量以光的形式释放,而放出的光的波长在可见光范围内,所以能使火焰呈现一定的颜色,故答案为:高能级上的电子跃迁到低能级释放能量。
(2)同一原子中不可能有4个量子数完全相同的电子,即同一原子中不可能有运动状态完全相同的电子存在,基态铝原子有13个电子,因此有13种电子运动状态;不同轨道的电子云形状不同,p轨道的电子云轮廓图的形状为纺锤形或哑铃型。
(3)①由已知,五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表),结合其局部结构图可得,R中阳离子是NH4+和H3O+;其中相对分子质量较大的阳离子是NH4+,中心原子为氮原子,含有4个σ键,无孤对电子,为sp3杂化。②如图所示R中阴离子N5-中的σ键总数为5个,根据已知信息,N5-中参与形成大π键的原子数为5,形成大π键的电子数为6,所以N5-中的大π键应表示为: ![]() 。
。
(4)①根据X耐高温的性质及氮化硼与X晶体类型相同,可知它们都是原子晶体,根据X的晶体结构图可知,晶胞中含有氮原子数为4,含有铝原子数为:8×![]() +6×
+6×![]() =4,所以X为AlN,氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,所以氮化硼的熔点比AlN高。②由前面分析、计算可得,晶胞中含有4个N和4个Al,所以晶胞质量为:
=4,所以X为AlN,氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,所以氮化硼的熔点比AlN高。②由前面分析、计算可得,晶胞中含有4个N和4个Al,所以晶胞质量为: ![]() g=
g=![]() g,因为密度为ρg·cm-3,所以晶胞棱长为:
g,因为密度为ρg·cm-3,所以晶胞棱长为: 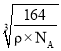 ;以立方体上面面心的Al原子(白球)为例,该Al原子所在面上的顶点处Al原子与其距离都是最近的,为晶胞棱长的
;以立方体上面面心的Al原子(白球)为例,该Al原子所在面上的顶点处Al原子与其距离都是最近的,为晶胞棱长的![]() 倍,所以晶体中最近的两个Al原子的距离为
倍,所以晶体中最近的两个Al原子的距离为![]() ×
×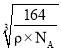 cm。
cm。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案