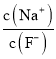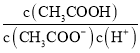题目内容
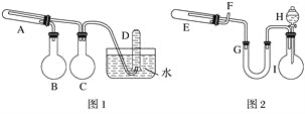
【题目】如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )
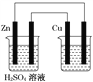
A. 铜在原电池中作负极,在电镀池中作阳极
B. 原电池溶液增加的质量比电镀池阴极增加的质量大
C. 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol
D. 电镀池中的电解质溶液可用ZnSO4溶液
【答案】C
【解析】电镀的要求是:镀层金属为阳极,待镀的部件为阴极,含有镀层金属阳离子的溶液为电镀液。所以,在铁棒上电镀铜时,铜为阳极,铁为阴极,溶液中一定要有铜离子。在锌铜原电池中,锌为负极,铜为正极,所以选项A错误。电镀池阴极的反应为Cu2++2e-=Cu,原电池的总反应为Zn+H2SO4=ZnSO4+H2↑,所有电极上的得失电子数一定相等。假设转移2mol电子,此时原电池溶液增加的质量为65-2=63g,电镀池阴极析出1molCu,质量为64g,所以选项B错误。Zn转化为Zn2+,所以锌棒每减少0.65 g(0.01mol),导线上转移的电子就为0.02 mol,选项C正确。电镀池的电解液应该是硫酸铜溶液,选项D错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目